Escala de colores de tintes
No es preciso tener los detectores olfativos de un cánido rastreador para saber qué fragancias no te gustan, mas es bastante difícil determinar la olor que deseas despilfarrar cuando tienes tantas opciones. Con cada marca de alto perfil y cada celebridad generando una nueva olor cada un par de meses, nos resulta bastante difícil determinar cuáles son las que verdaderamente resaltan y cuáles solo ocasionan mal olor. Esperamos que productos como escala de colores de tintes, colores de tintes o bien colores tintes cumplan tus espectativas. La mejor colonia para hombres o mujeres debe ser cuidadosamente emparejada con las situaciones y ocasiones concretas en las que se utilizará. Los seductores aromas oscuros, de tabaco y madera se amoldan a los acontecimientos nocturnos, mientras que las olores más frescas o bien cítricas marchan mejor para el empleo diario y la oficina. No hay nada de malo en oler como un trabajador, mas cuando llega la hora de refrescarse, ayuda a tener una ventaja. Bastantes personas ni siquiera se dan cuenta de lo esencial que es hallar y emplear una olor sexy.
Listado top ventas para Escala de colores de tintes
Deseamos que con este grupo de productos puedas encontrar escala de colores de tintes al mejor precio y mejor calidad para el cuidado y bienestar de tu salud. Te aseguramos que encontrarás la mejor selección de productos y precios de todo lo que necesitas para , dándote la oportunidad de descubrir numerosas referencias y marcas.

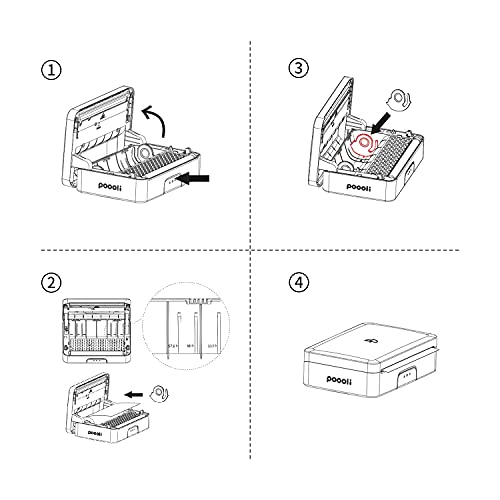
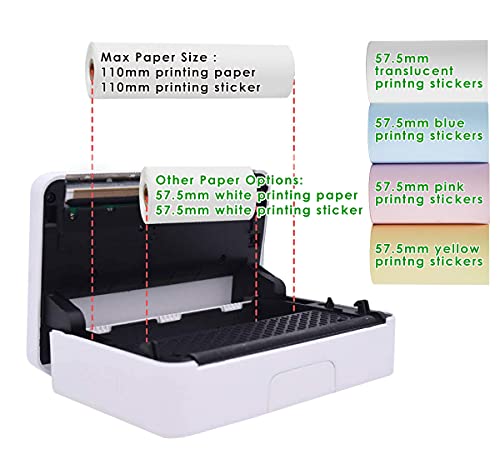
Impresora térmica inalámbrica Compatible con la Ventana de Android de iOS para Imprimir Pegatina, Logotipo, Etiqueta, recibo, Foto, Modo de impresión en Escala de Grises de 300 dpi
- Conexión Bluetooth, compatible con teléfono Android, iphone, ordenador portátil, tableta, escritorio
- Descargar Poooli imprimir aplicación de Apple Store y Googleplay,editar sus textos, lables, notas de estudio, saludos con la plantilla emojis incorporados e imprimirlos a través de poooli app.
- Tipo de papel de apoyo: 57.5mm Poooli pegatina térmica,57.5mm Poooli papel térmico, 110mm Poooli pegatina térmica,110mm Poooli papel térmico
- Máquina de impresión ecológica: Utilice tecnología sin tinta (tecnología térmica), sin tóner de tinta necesaria, ahorre energía y salve el mundo.
- Tamaño del bolsillo y diseño de la batería incorporado, hace posible la impresión en cualquier momento y en cualquier lugar necesario.


ColoWorld Remanufacturado 302 XL Cartuchos de Tinta para HP 302XL 302 Negro y Tricolor Compatible para HP OfficeJet 3634 3636 3830 5230 4650 5220 DeskJet 3630 1110 2130 3639 Envy 4528 4520 Impresora
- 【302XL CARTUCHO, MÁS PRINTED】-hasta 750 páginas por cartucho negro 302XL, 450 páginas por cartucho de color 304XL (basado en una cobertura del 5% de papel A4). El chip inteligente puede registrar la cantidad de tinta restante, por lo que puede recordarle si necesita pedir un nuevo cartucho de tinta para la impresora.
- 【COMPATIBILITY IMPRESORAS】-para HP DeskJet 1110 2130 2132 2134 3630 3634; OfficeJet 3830 3831 3832 3833 3834 3835 4652 4655 4658 5220 5230 5232; ENVY 4520 4522 4524 4527 Serie de impresoras.
- 【CALIDAD CONFIABLE】-Con la selección de materiales de primera clase, la producción automática avanzada ofrece impresiones de gran nitidez y gran brillo de color; Tiene una cubierta protectora de la boquilla para el cartucho de tinta, que desempeña un gran papel en el transporte a larga distancia.
- 【CONTENIDO DEL PRODUCTO】- ColoWorld Remanufacturados Cartuchos de tinta de Repuesto para HP-302XL Negros y 302XL Tricolor para HP-Impresora.(Multipack = 1 Negro+ 1 Tricolor=2 Confezioni= Combopack) Asegúrese de que se ajuste al número de modelo de su impresora.
- 【CONSEJOS DE USO】 - La función "Actualización de firmware" de Envy 5220/5230/5232/5255 puede evitar el uso de consumibles de terceros. Para obtener una experiencia de impresión de mayor calidad, lea la quinta y seis imágenes del artículo con respecto a las instrucciones de funcionamiento de Desactivación de la actualización automática de firmware para cartuchos de tinta 302 / 302XL.


Memento Luxe Tampón para Sello Fondo de Escala, Color Verde
- Tsukineko Memento Luxe Mixed Media Inkpad, Pistachio


Dispensador de color de pelo con bomba de tinte botella con escala graduada colorear peine cepillo herramienta de peine para salón raíz botella 80 ml
- Escobilla graduada: este cepillo de dientes es suave para desenredar tu cabello, las escalas en las botellas son prácticas para saber cuánto tinte de pelo has rellenado.
- Evita que se descascarille: este producto ayuda a distribuir uniformemente el tinte de tu cabello y evita masivamente el desorden.
- Mango de bombeo: simplemente rellena la botella de tinte con tu color y presiona el mango de la bomba para conseguir que el tinte pase por la cabeza del peine.
- Materiales de alta calidad: Hecho de material de polipropileno de alta calidad, duradero, ecológico e inofensivo.
- Múltiples usos: es muy adecuado para uso profesional de peluquería y uso doméstico.


POFET 3 botes aplicadores de peine, peine de botella con escala graduada para teñir el cabello, colorear, tratamiento esencial
- La botella para manchas de pelo proporciona una gran comodidad cuando se tiñe en casa. Nunca tendrás que preocuparte de que esta botella de tinte desperdicie tinte y fije el peine, que es más fácil de teñir que los métodos tradicionales.
- La solución se puede aplicar simplemente peinando y apretando, y el líquido fluye directamente a través de los dientes huecos hacia el cuero cabelludo y las raíces, distribuido uniformemente, sin ensuciar y facilidad de uso.
- Simplemente llena la botella de peine de raíz con color de pelo premezclado y utiliza un mango de bombeo para permitir que el tinte fluya a través del peine, la botella graduada y mezcle fácilmente el cromo.
- Este producto es fácil de transportar y transportar. Es fácil de lavar el cabello incluso sobre la marcha. No necesitas cabello graso para soportar malos sentimientos.
- La mejor opción para peluquería, tiendas de mascotas, uso doméstico y así sucesivamente.


CXtech Botella de Pincel de Tinte para el Cabello Champú Pincel Aplicadoras Botellas para Teñir el Cabello con Peine y Escala Graduada Blanco
- OPERACIÓN SIMPLE: Con diseño humanizado, simplemente llene la botella de tinte con su tinte premezclado y utilice el mango de la bomba para que el tinte fluya a través del cabezal del peine
- DISEÑO ESPECIAL: Cuerpo de la botella de tinte cuenta con escala, los dientes de peine tienen los agujeros de agua, se puede utilizar como botella de la limpieza en seco, también puede ser peine del teñido del pelo
- LIGERO Y PORTÁTIL: La botella aplicadora de peine es ligero, fácil de transportar y llevarse. Es fácil lavarse el cabello hasta mientras viaja. Puede lavar su cabello o teñirlo dondequiera evitando el cabello graso
- MATERIAL: El bote aplicador de tinte para el pelo está hecho de plástico de alta calidad, que es suficientemente duradero para un uso prolongado. El plástico suave y duradero hace que sea fácil de apretar colorante fuera
- APLICACIÓN AMPLIA: Las botellas de lavado también pueden ser como botella de limpieza en seco, botella de champú pincel, botella de tinte para el cabello, etc. Adecuadas para uso en hogar, peluquería, salón, entre otros


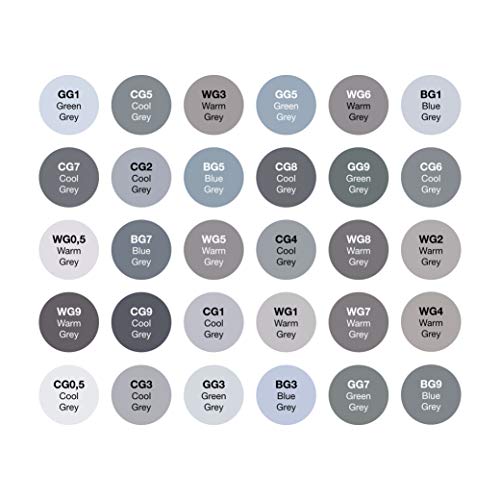
OfficeTree Set con 30 Marcadores de Fibra Touch Twin Marker – Tono de Grise - para Diseño, Bocetos, Ilustraciones, Dibujo
- MÁXIMO RENDIMIENTO - 30 marcadores de OfficeTree, basados en alcohol para transiciones suaves de color, secado rápido, puntas de 1 mm y 2-6 mm
- DOBLEMENTE MEJORES - Punta fina para detalles, punta ancha para trabajo plano, tapa de seguridad con códigos de color
- TRAZO LIMPIO: sin difuminar los colores, sin bordes feos, distribución de colores suaves para obtener excelentes resultados
- ARTISTAS DE LA VERSATILIDAD: amplia paleta de colores, perfecta para dibujos, manga, diseños, scrabbooking, gráficos, arquitectura de interiores y mundo de la moda
- CALIDAD - Alta calidad, en una elegante caja para un almacenamiento seguro y fácil transporte


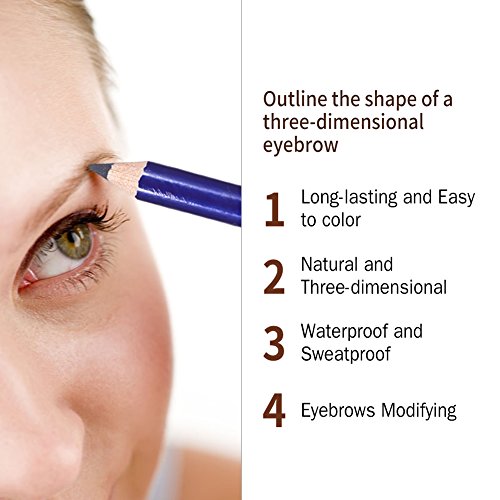
Lápiz de cejas semi permanente, Bolígrafo de Cejas de Posicionamiento de Microblading de 3 colores, Lápiz de cejas impermeable doble cabeza con escala y borrado(marrón)
- Cejas definidas naturalmente: logre un aspecto muy natural con el tinte similar a un pincel que definirá las cejas desde el ancla hasta la cola, para las cejas que enmarcan suavemente su rostro.
- Resistente al agua: el lavado con agua no es fácil de desvanecer, resistente al agua, a prueba de sudor, a prueba de manchas.Tus cejas se mantendrán tan naturales y llenas como lo fueron al principio.
- Diseño de doble punta: lápiz de doble punta, un lado se usa para dar forma a la ceja, el otro lado para limpiar los lugares equivocados.Puedes crear fácilmente las cejas que siempre has deseado con nuestro lápiz de cejas profesional para maquillaje.
- Uso duradero y amplio: el lápiz de cejas es más suave y delgado, puede ser permanentemente resistente a las manchas.Sin esfuerzo puedes sostener una hermosa ceja.Perfecto para salón profesional, bodas, fiestas, uso doméstico.
- Rendimiento: la recarga no es suave ni dura, no es fácil caerse del lápiz de cejas y la dureza es moderada.Se puede usar durante mucho tiempo y el efecto de maquillaje permanecerá desvaneciéndose durante todo el día.


Canon PG-37 Cartucho de Tinta Original Negro para Impresora de Inyeccion de Tinta Pixma MP140-MP190-MP210-MP220-MP470-iP1800-iP1900-iP2500-iP2600
- Marca-Canon
- Referencia-2145B001
- Marca-Canon-El producto es original y exclusivo de la marca -Canon- CARTUCHO TINTA NEGRO PG-Pertenece a la categoría de los consumibles-Referencia-2145B001
- Dispositivos compatibles: No aplica
- número de páginas impresas: 450


Memento Luxe Plena Escala Inkpad-Tuxedo, Color Negro
- Tsukineko Memento Luxe Mixed Media Inkpad, Tuxedo Black

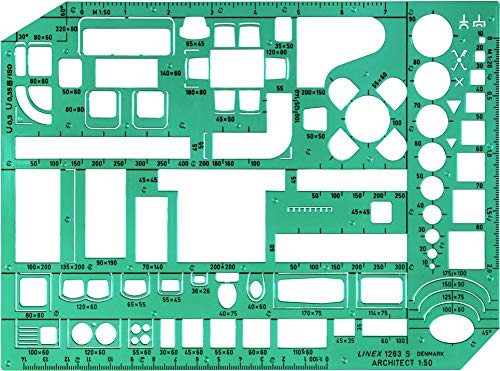
Linex LXG1263S - Plantilla para dibujar muebles (con símbolos de muebles y habitaciones, escala 1-50, 230 x 160 mm, tintada), color verde
- Linex Furniture Template with Furniture and Room Symbols Scale 1-50 230x160mm Tinted Green Ref LXG1263S


HP 953XL 3HZ52AE, Pack de 4, Cartuchos de Tinta Originales de alto rendimiento, Negro y Tricolor, compatible con impresoras HP OfficeJet Pro 7720, 7730, 7740, OfficeJet Pro Series 8000
- Cartuchos Originales HP 953XL, pack de 4,compatible con impresoras de inyección de tinta HP OfficeJet Pro 7720, 7730, 7740; OfficeJet Pro Series 8000
- Óptimo para imprimir fotografías con calidad de laboratorio y documentos de oficina con resultados uniformes; el rendimiento medio del cartucho es de 2000 páginas en negro y 1600 por cada color
- Diseñado en armonía con el medio ambiente: HP piensa en el planeta al comprometerse con soluciones sostenibles, programas de reciclaje y eliminación de residuos
- Cartucho con cabezal integrado: cada vez que se reemplaza el cartucho, el cabezal de impresión se regenera, ofreciendo un nuevo ciclo de trabajo
- Solo los cartuchos HP Originales están diseñados específicamente para impresoras HP y, a diferencia de los cartuchos no originales, garantizan fiabilidad y servicios adecuados
- Obtén un mayor ahorro económico y evita pérdidas de tiempo comprando cartuchos Originales HP para tu impresora, el paquete contiene cuatro cartuchos 953 XL Negro y Tricolor


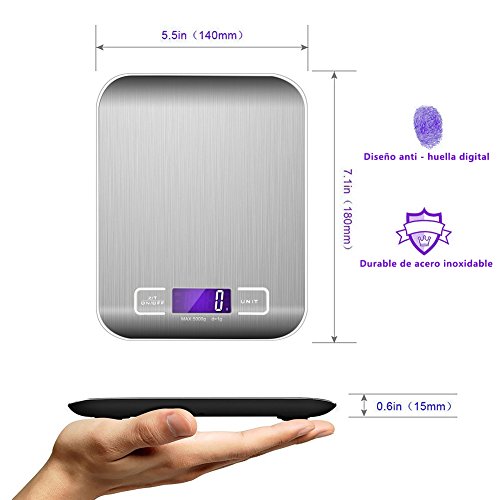
GPISEN Smart Digital Báscula con Pantalla LCD para Cocina de Acero Inoxidable, 5kg/11lbs, Balanza de Alimentos Multifuncional,Color Plata,(2 Baterías Incluidas)
- Diseño bonito: Su tamaño es de 18 * 14 * 1.8cm.Pesar hasta 5000g (11 libras); Graduación: 1g/0.01oz.No ocupa espacio en un armario y es fácil de llevar a todas partes Perfecto para hornear, cocinar y pesar joyas
- Auto-Tara: Calcula el peso neto de sus ingredientes; Resta automáticamente el peso de cualquier tazón o recipiente; Auto-apagado (2 minutos) para ahorrar energía
- Gran pantalla LCD: Diseñado con una pantalla LCD de alta calidad, fácil de leer en Convertir unidad rápidamente entre de g-kg-lb-oz-ml-milk/ml(1 kg=1000 g=2.2 libras=35 oz).Indicador de batería baja.
- Buena calidad: Funciona con 2 pilas AAA (incluidas) con un compartimiento de pilas de fácil acceso; Cumplir con la certificación CE / ROHS; Garantía de 2 años por GPISEN
- Material: Plataforma de acero inoxidable Resina ABS (acrilonitrilo butadieno estireno) diseñado para una fácil limpieza y mantenimiento.

Imágenes de Escala de colores de tintes
Aquí tienes una serie de fotografías de escala de colores de tintes para que te formes una idea y puedas elegir entre todos los modelos de perfume. Pincha con el ratón en una de las fotos para ver la ficha íntegra del artículo y su costo.