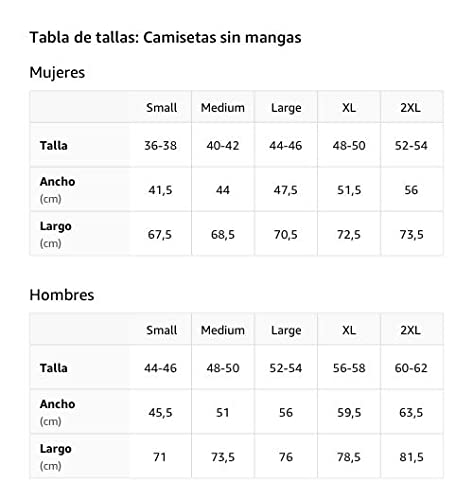
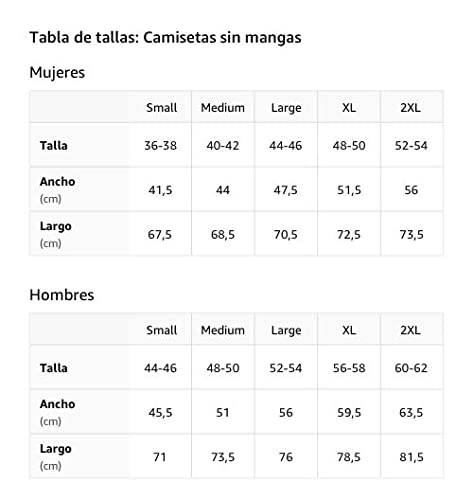
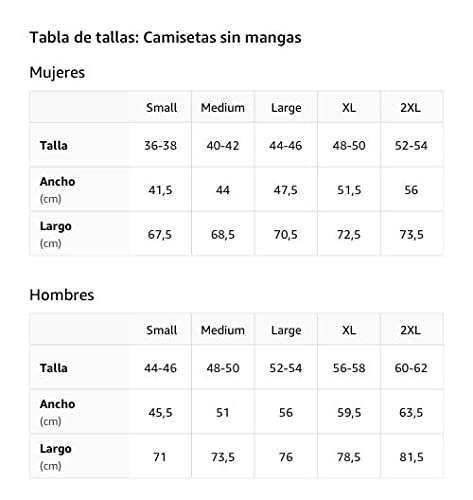
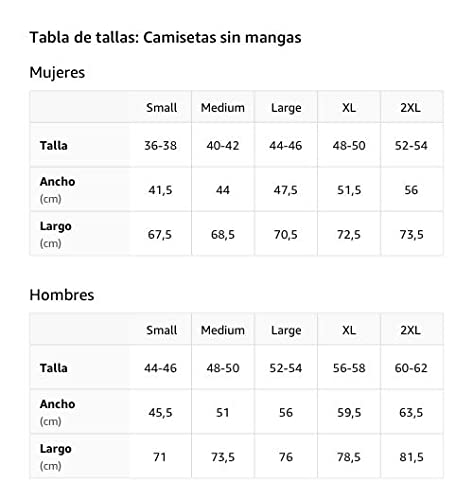
Tirante de reaccion
Los mostradores de belleza y las tiendas on line de incontables compañías de perfumes están repletos de lo último y lo mejor, con lo que ¿cómo sabes cuál va a ser tu próximo destino? Pues te lo decimos nosotros: tirante de reaccion,
Listado top ventas para Tirante de reaccion
Aquí podrás encontrar multitud de productos como tirante de reaccion muy buenos para el cuidado de tu salud. Encuentra numerosas referencias de diferentes modelos de la mejor calidad y con predio competitivo para todo lo que necesitas para tu cuerpo.

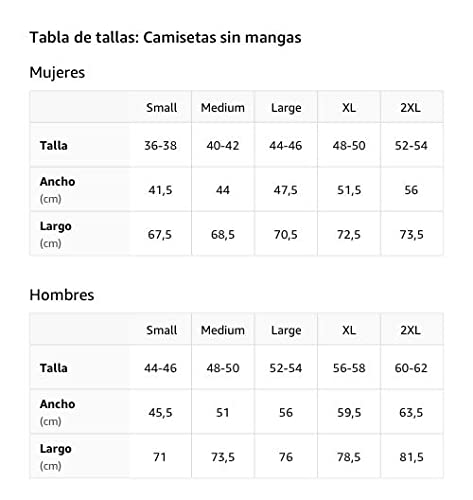
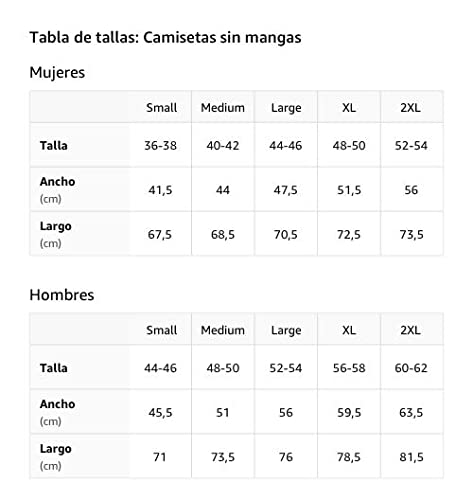
Reacción excesiva Camiseta sin Mangas
- Obra de arte gráfica: WRD-C058
- Ligero, Encaje clasico, manga de doble puntada y bastilla baja


Primer choque de reacción Camiseta sin Mangas
- Impacto de primera respuesta
- Impacto de primera respuesta
- Ligero, Encaje clasico, manga de doble puntada y bastilla baja


Aviación militar de reacción Camiseta sin Mangas
- combatiente
- combatiente
- Ligero, Encaje clasico, manga de doble puntada y bastilla baja


actuación musical reaccionar teatro ensayo mejorar teatro Camiseta sin Mangas
- La divertida cita que reacciona. ¿Eres actor o actriz? ¿Te gusta tocar, actuar y jugar en el teatro o musical? Perfecto para el próximo ensayo de teatro.
- Ligero, Encaje clasico, manga de doble puntada y bastilla baja


La imagen de la reacción de meme de la mujer divertida de meme Camiseta sin Mangas
- Cuando ves algo loco que te hace solo querer decir qué? Divertidas imágenes de reacción de mujer con la cita. Camiseta con cita de meme vanguardista. Regalo para amantes de los memes. Ropa vintage con memes publicitarios.
- Piensa en alguien que ama los memes tontos. Gran idea de regalo para los amantes de los memes dancos. Camiseta de memes para hombres, mujeres, niños, niñas y niños en memes de Internet. Regalo de cumpleaños, Navidad o aniversario.
- Ligero, Encaje clasico, manga de doble puntada y bastilla baja


Divertidos Dichos Reacciones De Juego Reacciones De Juego Camiseta sin Mangas
- ¿Perteneces a la comunidad de juegos? ¿Eres un verdadero jugador, streamer o simplemente como reactments? Entonces, esta repetición de reacción divertida de juego dice que los dichos diseña para el jugador o el derecho del jugador para usted.
- Muestre su amor por los juegos. Diseño de juego de hobby ideal, ya sea hombre, mujer o niño. Muestre su amor por el mando con el divertido diseño de jugador de PC o consola.
- Ligero, Encaje clasico, manga de doble puntada y bastilla baja


LIOOBO Bola de Reacción de 2 Piezas de Pelota de Reacción Bola de Entrenamiento para Velocidad Agilidad
- FÁCIL DE USAR: simplemente haga rebotar la bola de reacción en cualquier pared, piso o superficie dura, y la bola rebotará en direcciones aleatorias.
- DISEÑO DE SEIS CARAS: la pelota de entrenamiento rebotará en direcciones aleatorias para que su agilidad y velocidad de reacción puedan entrenarse de manera efectiva.
- ÚTIL: es una forma divertida de mejorar sus reflejos y agilidad, velocidad de reacción, mejorar la coordinación mano-ojo y puede usarse como una herramienta de ejercicio de rehabilitación.
- MULTIPROPÓSITO: ideal para béisbol, softbol y fútbol, baloncesto, tenis, bádminton y otros deportes de agilidad.
- Estamos comprometidos a proporcionar productos y servicios de buena calidad al cliente. Si tiene alguna pregunta, no dude en contactarnos.


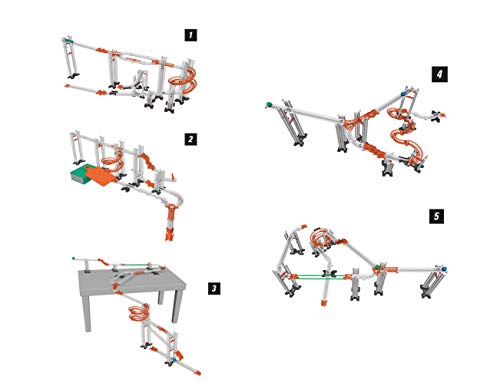
Clementoni - Action & Réaction - Efecto Caos, pistas y construcciones STEM, a partir de 8 años (55377)
- Un increíble kit científico para construir circuitos con sorprendentes efectos sin fin
- Montones de piezas y accesorios especiales para crear un número ilimitado de rutas que pueden personalizarse con objetos caseros cotidianos para dar rienda suelta a la imaginación y desencadenar el efecto caos
- Desafía las leyes de la gravedad con el embudo, duplica las rutas con salidas y crea efectos inesperados con el hacha, el puente de suspensión y el guarda raíl
- El manual ilustrado guiará al niño para crear circuitos con niveles crecientes de dificultad, ofreciendo muchas ideas para completar las pistas e introduciéndoles a la física


SYROKAN - Sujetador Deportivo con Aros Espalda Deportiva Sin Relleno para Mujer Negro 100B
- Copas sin relleno con aros
- Con amplia tirantes ajustables
- Espalda deportiva realizada en Power Net, adecuado para deportes extremos
- Tejidos de alto rendimiento y zonas de malla transpirable - mantener el cuerpo fresco


Chalecos Reflectantes, JTDEAL Chaleco Reflectante Alta Visibilidad Arnés Elástica Ajustable Ligero, Niñas y Mujeres, para Correr, Andar en Bicicleta, Caminar, Hacer Deportes en Exterior Etc - Verde
- Alta Visibilidad y seguro: Las bandas reflectantes cubren todas las áreas del arnés delantero y trasero, sin dejar puntos ciegos, reflectancia de 360°y visibilidad que refuerza su seguridad. Es extremadamente brillante y claro, y los reflectores centrales son lo suficientemente anchos como para reflejar mucha luz hacia atrás
- Aplicación amplia: Perfecto para cualquier actividad al aire libre como correr, montar en bicicleta, caminar, ciclismo, motociclismo, persiga caminar, patinar, autostop, sacar a pasear perro, fabricas, cadenas de montaje, etc
- Ajustable y fácil de usar: Las correas elásticas super-elásticas hacen que se adapte para adulto / niño y le dan mucho espacio para moverse y adaptarse a lo que está usando. La hebilla POM es resistente y fuerte en la parte delantera, se libera muy rápidamente con una presión mínima. Realmente fácil de usar ya que sólo tiene que ajustarlo alrededor de su cuerpo y ajustar las bandas
- Moda y cómodo: El chaleco entero engranaje reflexivo así que usted no sobrecalienta, y cómodo usar (apenas lo sienta encendido). No hay frotamiento o chaffing, no restringe el movimiento. Se pliega en una bola muy pequeña por lo que puede caber en el bolsillo de cualquier persona, incluso o un pequeño bolso, o la guantera del coche
- A veces es un camino de alto riesgo y las horas de luz son limitadas por la noche, el chaleco es mejor opción. Nuestro chaleco reflectante es ligero, fácil de llevar, y hace deportes al aire libre en todo tipo de clima mucho más cómodo


DELIMIRA - Sujetador Sin Tirantes con Aros Invisible para Mujer Beige 105D
- Bordes internos que lleva una tira de sin antideslizante
- Copas completas sin relleno para max conforto
- Con aros y suaves varillas laterales que ayudan a sostener
- Lavar a mano


Masculinidades Igualitarias y Alternativas. Procesos, Avances y Reacciones (Diáspora)


Clementoni - Ciencia y Juego Action & Reaction Crazy Dominó (59126) , color/modelo surtido
- Con este kit científico, descubrir las maravillas de la física es algo fácil y muy divertido en Español
- Un laboratorio de ciencia con piezas especiales y accesorios que ofrecen muchas opciones de juego en las que los niños pueden experimentar con la gravedad, las fuerzas y las palancas
- Incluye circuitos, un péndulo, láminas, torres y muchas otras piezas para que los niños crezcan en conocimiento mientras construyen ingeniosas composiciones
- Crea los circuitos más bonitos con todas las piezas que se incluyen, y completa la dificultad con los accesorios disponibles
- El manual ilustrado guiará a los niños mientras intentan tareas cada vez más difíciles, entreteniéndoles mientras aprenden


Cette Flash Tape Cinta Adhesiva de lencería, Blanco (Clear 390), única (Talla Fabricante: Regular) para Mujer
- Adecuado para mujer
- Tamaño única (Talla fabricante: Regular)
- Fabricado en material 100% poliacrílico
- Color transparente

Imágenes de Tirante de reaccion
Aquí tienes una agrupación de fotografías de tirante de reaccion para que te formes una idea y puedas seleccionar entre todos los tipos de perfume. Pincha en una de las fotos para ver la ficha entera del artículo y su costo.