Estructura piramidal maquillaje
Para asistir a guiar tu busca, es una buena idea meditar en las fragancias de acuerdo a las distintas categorías: florales, frutales, madereras o bien limpias, en tanto que la mayoría de la gente se inclina innatamente hacia una de ellas. Eso te va a ayudar a reducir las opciones, por lo menos un poco y vas a poder enfocarte en productos más llamativos para ti como estructura piramidal maquillaje, estructura formal e informal del corte ingles o bien maquillaje s. Comprar de forma más inteligente significa invertir en cosas que te hagan sentir bien, como una nueva fragancia. Los estudios muestran que el aroma tiene el poder de evocar recuerdos positivos que mejorarán su estado de ánimo y reducirán el estrés. Ciertas esencias pueden mejorar la memoria, la productividad, la concentración, la atención sostenida y la función cognitiva. Esencialmente, la olor puede hacer más que hacerte oler bien.
Listado top ventas para Estructura piramidal maquillaje
Queremos que con este grupo de productos puedas encontrar estructura piramidal maquillaje al mejor precio y con la calidad óptima para el cuidado y bienestar de tu cuerpo. Te aseguramos que llegarás a encontrar la mejor selección de productos y precios de todo lo que necesites para tu cuerpo, ofreciéndote la opción de descubrir varias referencias y marcas.

Estuche portátil de cuero Pu para lápices, estuche de maquillaje cosmético piramidal, portalápices escolares de moda con cremallera
- ☆ Material de calidad: este estuche para lápices está hecho de tela Oxford / cuero sintético. La buena tela la hace lavable y resistente a la abrasión, puede funcionar para usted de manera continua y eficiente.
- ☆ Diseño de apertura de doble cremallera: es una bolsa pequeña con una diferencia. Tiene Dos Aberturas Con Cremallera Y Puedes Llevar Elementos En La Parte Superior Y Los Lados. La bolsa grande de almacenamiento para lápices puede contener más de 50 bolígrafos.
- ☆ Ligero pero de buena capacidad: te sorprenderá que pueda contener tantas cosas. Esta bolsa se puede usar como bolsa de maquillaje, estuche de viaje, bolsa, organizador, monedero, bolsa de papelería, estuche para lápices, etc. , Billetes, Tarjetas, Monedas, Llaves, Accesorios De Maquillaje Y Papelería.
- ☆ Fácil de llevar: está equipado con una correa de mano duradera, se puede llevar en la mano donde quieras. Idea de regalo para adolescentes, niñas, niños, hombres y mujeres.
- ☆ Satisfacer los servicios: este es un estuche de diseño único, espero que pueda ser amado por los consumidores. Siempre hemos insistido en la calidad, y cada estuche para lápices debe brindar satisfacción a los consumidores. Si tiene alguna pregunta o sugerencia sobre nuestros productos, bienvenido a contactarnos.


Haorw Molde de Resina, Paleta de Maquillaje cosmética Herramienta de espátula Moldes de fundición de Resina Moldes Redondos Irregulares A
- Hecho de silicona, ecológico, no tóxico, flexible, reutilizable y duradero.
- Antiadherente, fácil de separar, resistente a la temperatura, fácil de limpiar, ecológico, bajo en carbono, se puede reciclar.
- Sencillo y útil, saludable, resistente a la corrosión y adaptabilidad.
- Perfecto para ti y tu familia haciendo bricolaje juntos.
- Regalo único para alguien que valora: dé sus regalos a sus seres queridos, amigos en cumpleaños, Navidad, Año Nuevo, bodas, etc.


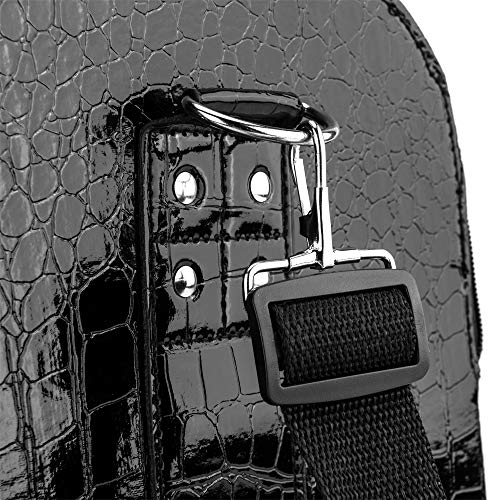
AMASAVA Maletín Maquillaje, Estuche de Maquillaje, Estuche de cosméticos, 29 x 24 x 24 cm, PVC, 4 bandejas, Negro Puro
- 💖【Resistente a la abrasión y antisuciedad】 El exterior de maletín maquillaje está hecho de material de PVC, que es antisuciedad y brillante. La superficie del estuche maquillaje tiene patrón de cocodrilo, que es más hermoso y resistente al desgaste. La parte inferior de la maletín maquillaje está equipada con cuatro soportes metálicos para evitar que la parte inferior se frote contra el suelo para producir manchas
- 💖【Suficiente espacio interno 】 El interior de Estuche de Maquillaje consta de tres capas, divididas en dos bandejas, izquierda y derecha, con suficiente espacio para sus cosméticos
- 💖【Robusta manija y cremallera 】 A diferencia de otros manijas rígidos,el costado de la caja de maquillaje AMASAVA tiene manijas más bonitas y fuertes.Al mismo tiempo,el cierre es más suave y no pegajoso
- 💖【Correa de hombro ajustable gratis】 El producto está equipado con una correa de hombro ajustable, que se puede ajustar según el individuo, lo que es más conveniente para uso
- 💖【Regalo Perfecto】 La bolsa de maquillaje Amasava es un regalo ideal para los demás. También es un emocionante regalo de vacaciones o cumpleaños para sus amigos y familiares


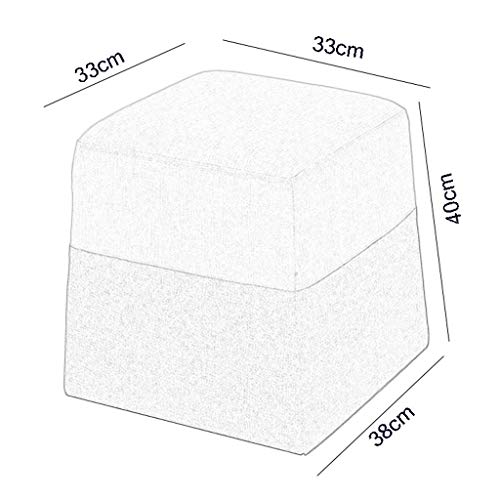
MTYLX Inicio Portátil Paso de Heces, Heces Sofá de la Tela Del Maquillaje Creativo de la Manera Casa Cuarto de Vestir Dormitorio Altura de la Puerta Plaza Los 40Cm,Marrón
- ☞La Fecha de Entrega Del Producto Es de 10-25 Días, Dependiendo de Su País O Región, por Favor Sea Paciente.
- ☞Garantía de Producto: Los Productos Son Productos de Alta Calidad, Estamos Comprometidos con el Mejor Servicio, Puede Estar Seguro de Comprar
- ☞Especificaciones: Amarillo, Verde, Marrón, Azul, Rojo, 33Cm Superior Longitud, 33Cm Ancho, Biselado 40Cm de Longitud, la Longitud de 38Cm Parte Inferior, Se Puede Colocar en la Sala de Estar, Se Pueden Utilizar para Cambiar el Banco de Zapato, Sofá Pie Heces
- ☞Detalles: 1. el Diseño Único de la Tela Costura, Las Partes Superior E Inferior Son de Empalme de Lino Mezclado para Asegurar Que la Superficie de Contacto Transpirable Y Cómodo; 2. Adoptan Deliberadamente la Estructura Piramidal de Pequeños Y Grandes, Que Puede Asegurar Que la Fuerza de Cualquier Ángulo por Encima Puede Mantener Las Heces. Equilibrada en Posición Vertical, No Se Mueve; 3. Esponja de Alta Densidad, Rebote Rápido
- ☞Material: Está Hecho de Poliéster Fina Y Ropa de Tejido Mezclado para Asegurar de la Tela de la Comodidad Respirable, Algodón Y Protección Del Medio Ambiente de Lino, Usable Y Libre de Bola, Fácil de Secar, Y la Tasa de Encogimiento Después Del Lavado Es de 5% Baja, Puede Ser Fácilmente Volver.


MTYLX Inicio Portátil Paso de Heces, Heces Sofá de la Tela de Maquillaje de Moda Creativa Inicio Vestir Dormitorio Habitación Altura de la Puerta Los 40Cm,Marrón
- ☞La Fecha de Entrega Del Producto Es de 10-25 Días, Dependiendo de Su País O Región, por Favor Sea Paciente.
- ☞Garantía de Producto: Los Productos Son Productos de Alta Calidad, Estamos Comprometidos con el Mejor Servicio, Puede Estar Seguro de Comprar
- ☞Especificaciones: Marrón Claro, Naranja, Blanco Verde, Marrón, Gris, Negro Verde, Púrpura, Azul, 33Cm de Diámetro Superior, Inferior 38Cm de Diámetro, 40 cm de Altura, Se Pueden Colocar en la Sala de Estar, Que Puede Hacer el Banco de Zapatos, Sofá Taburete
- ☞Detalles: 1. el Diseño Único de la Tela Costura, Las Partes Superior E Inferior Son de Empalme de Lino Mezclado para Asegurar Que la Superficie de Contacto Transpirable Y Cómodo; 2. Adoptan Deliberadamente la Estructura Piramidal de Pequeños Y Grandes, Que Puede Asegurar Que la Fuerza de Cualquier Ángulo por Encima Puede Mantener Las Heces. Equilibrada en Posición Vertical, No Se Mueve; 3. Esponja de Alta Densidad, Rebote Rápido
- ☞Material: Está Hecho de Poliéster Fina Y Ropa de Tejido Mezclado para Asegurar de la Tela de la Comodidad Respirable, Algodón Y Protección Del Medio Ambiente de Lino, Usable Y Libre de Bola, Fácil de Secar, Y la Tasa de Encogimiento Después Del Lavado Es de 5% Baja, Puede Ser Fácilmente Volver.


MTYLX Inicio Portátil Paso de Heces, Heces Tela Costura de Cuero Sofá de Maquillaje de Moda Creativa Inicio Vestir Dormitorio Habitación Altura de la Puerta Los 40Cm,Rojo Púrpura
- ☞La Fecha de Entrega Del Producto Es de 10-25 Días, Dependiendo de Su País O Región, por Favor Sea Paciente.
- ☞Garantía de Producto: Los Productos Son Productos de Alta Calidad, Estamos Comprometidos con el Mejor Servicio, Puede Estar Seguro de Comprar
- ☞Especificaciones: Azul, Azul Oscuro, Rojo Púrpura, 33Cm Parte Superior de Diámetro, 38Cm Parte Inferior de Diámetro, 40 cm de Altura, Se Puede Colocar en la Sala de Estar, Se Pueden Utilizar para Cambiar el Banco de Zapato, Sofá Pie Heces
- ☞Detalles: 1. el Diseño Único de la Tela Costura, la Parte Superior Es de Empalme de Lino Mezclado, Transpirable Y Cómodo, la Parte Inferior Es Fácil de Tocar la Parte Sucia con el Medio Ambiente de la Pu, Fácil de Limpiar; 2. Adoptar Deliberadamente la Estructura Piramidal de Pequeños Y Grandes, Las Heces Se Mantengan en Posición Vertical Equilibrado, sin Moverse; 3. Esponja de Alta Densidad, Rebote Rápido
- ☞Material: Está Hecho de Poliéster Fina Y Ropa de Tejido Mezclado para Asegurar de la Tela de la Comodidad Respirable, Algodón Y Protección Del Medio Ambiente de Lino, Usable Y Libre de Bola, Fácil de Secar, la Tasa de Encogimiento Después Del Lavado Es de 5% Baja, Se Puede Poner Fácilmente Espalda, la Parte Inferior Es de Cuero. Materiales, Fácil de Limpiar, Resistente Al Desgaste

Imágenes de Estructura piramidal maquillaje
Aquí puedes ver un conjunto de fotos de estructura piramidal maquillaje para que te hagas una idea y puedas seleccionar entre todos los tipos de colonia. Pincha en una de las imágenes para ver la ficha completa del producto y su coste.