Modelo 187
Un perfume propio, en cualquier circunstancia y a cualquier edad, ha de ser intemporal y llevable. Pero, como es natural, elegir el perfume adecuado para puede ser un reto con tantas fragancias en el mercado. Por este motivo aquí te dejamos las mejores como modelo 187, modelo epicee o acqua di gio modelo. Lo que, desafortunadamente, quiere decir que para la mayoría de las personas puede ser bastante difícil seleccionar la colonia adecuada a su personalidad, que sea accesible y que venga con un aroma que le guste. No obstante, no tiene por qué razón ser de este modo. Con las herramientas apropiadas, vas a poder escoger el perfume más adecuado a tu personalidad, complementar tu look y adaptarte a cualquier ocasión - desde fiestas a bodas y primeras citas hasta conocer a los suegros. Así sea en los días de cánido en verano o en una noche de cena en los mejores restaurants de Michelin, la colonia conveniente puede complementar cualquier ocasión. Si bien muchos expertos pueden eludir recomendar el empleo de una colonia en una entrevista o bien en la primera cita, en buena medida siempre pasan por alto el mero hecho de que se trata tanto de la aplicación conveniente como del uso de la mejor colonia para complementar el entorno.
Listado top ventas para Modelo 187
Esperamos que con este listado de productos encuentres modelo 187 al mejor precio y buena calidad para el bienestar y cuidado de tu salud. Nos queremos comprometer a que podrás encontrar la mejor selección de productos y precios de la totalidad de lo que necesitas para tu cuerpo, ofreciéndote la opción de descubrir diferentes modelos y marcas.

Vans Ward Platform Canvas Zapatillas Mujer, Negro (Canvas) Black/White 187), 36 EU (3.5 UK)
- Material exterior: Lona
- Revestimiento: Tela
- Material de la suela: Goma
- Cierre: Cordones
- Altura del tacón: 3 centímetros
- Tipo de tacón: Tacón ancho
- Composición: Textile
- Anchura del zapato: Normal


MOEGEN 187 piezas de puzle 3D de madera cortada a láser, modelo de construcción, regalo para niños y adultos, moto
- MOTORRAD MODEL KIT: Baugruppengröße: 28.8 x 11.8 x 11.5 cm, no necesita pegamento Este juguete de montaje DIY se puede colocar en la sala de estar, dormitorio, oficina, estudio u otras decoraciones de interior.
- Alta calidad: juego de construcción de madera contrachapada 3D puzzles están hechos de madera fiable, lo que los hace duraderos, respetuosos con el medio ambiente y fáciles de montar sin pegamento.
- Fácil construcción autónoma: fácil extracción de las piezas individuales de las hojas. Fácil de entender y seguir con las instrucciones detalladas (idioma español no garantizado).
- Regalo perfecto: la mejor opción para alguien que ama las aficiones artesanales. Gran elección como regalo de cumpleaños, regalo de Navidad y San Valentín.
- Un proyecto educativo significativo: el modelo artesanal puede abrir un nuevo mundo de la creatividad, el conocimiento y el placer. Es una buena idea pasar un tiempo agradable con tu familia y amigos, disfrutar del tiempo libre y relajarte.

kwmobile Carcasa para Sony Xperia 5 III - Funda para móvil en TPU Silicona - Protector Trasero en Violeta Burdeos
- COMPATIBILIDAD: Compatible con Sony Xperia 5 III.
- PROTECCIÓN CON ESTILO: Este cover te gustará por su atractivo y elegante diseño. Además es robusto, sólido y estable, protegerá la parte posterior de tu teléfono.
- SIN RIESGOS: La funda antideslizante te dará seguridad, evitando que tu dispositivo se resbale. Su material permite un agarre seguro. Además, es gruesa y resistente.
- GRAN FLEXIBILIDAD: La carcasa de TPU es especialmente elástica, suave y ligera. El forro antideslizante se adapta perfectamente a tu teléfono inteligente.
- SENCILLA: Este tipo de funda trasera cuenta con un diseño sobrio y sencillo, además de ser fácil de colocar.


Norev - 187 591 - Porsche - Carrera 911/993 - 1995 - 1/18 Escala
- Miniatura, coche, colección
- Edad mínima : 14 años
- Tamaño: 30 x 12 x 12 cm


Topological Insulators: Dirac Equation in Condensed Matter (Springer Series in Solid-State Sciences Book 187) (English Edition)


Tattoo Revue Magazine Issue 188 (English Edition)


US Army, Technical Manual, TM 5-6675-330-12&P, SURVEY EQUIPMENT, DISTANCE MEASURING, ELECTRONI RANGE MODEL/PART NO 76-0507-1, (NSN 6675-01-187-5139) (English Edition)


Financial Models with Levy Processes and Volatility Clustering: 187 (Frank J. Fabozzi Series)


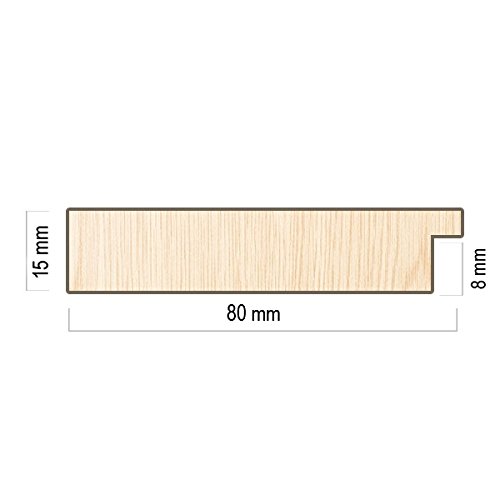
-Espejo Fabricado en España- tamaño 55x150 cm. Espejo Decorativo de Pared Modelo 187 Perla, Ideal para salón, Dormitorio, vestidor, baño o Pasillo
- Medida Exterior del marco 55x150 cm, medida de espejo 40x135 cm. Moldura en MDF de gran calidad de 8 cm de ancho, terminada en perla. Está fabricada por nosotros, es un producto hecho en España.
- Si desea el marco en otro color, una vez realizada la compra envíenos un mensaje vía Amazon (contactar con el vendedor) indicando el color que desea..
- Espejo de 4 mm nacional, aporta excelentes calidades ópticas y no deforma la imagen como la mayoría de los importados.
- Incluye kit completo con 2 colgadores e instrucciones para colocarlo en horizontal o vertical.
- Está fabricada por nosotros, es un producto hecho en España.


Loi Maletín Arma Corta rígido Modelo A312508 (31 x 25 x 8)
- Características: * Maletín portátil económico y seguro para arma corta, pistola, revólver, cargadores... * Interior egg FOAM espuma precortada * medidas exteriores: 310x256x80mm * Medidas internas: 295x187x65mm * Cierres bloqueables
- * Material: Engeenering PP alta resistencia * Peso neto: 0.435 kg Peso total: 0.50 kg * Profundidad de la tapa: 3.25 cm * Profundidad de la base: 3.25 cm * Temperatura soportada: -10ºC~60ºC
- * Apta para el cierre con candados (no incluidos) Similar a maletín Arizona Maletin multiusos: caja barata arisoft, caja de plástico, caja con cierres, maletin barato, maleta m4 pistola, funda airsoft, caja con cierres tipo Arizona


Fruit of the Loom - Camiseta Básica de Manga Corta Modelo Valueweight - Hombres (S/Azul Jaspeado Vintage)
- Camiseta de manga corta para hombre con cuello redondo.
- Material de alta calidad para realizar impresiones en él.
- También disponible modelos de mujer y niño.
- Fabricada con hilo de Belcoro.
- Peso: 160-165g/m².


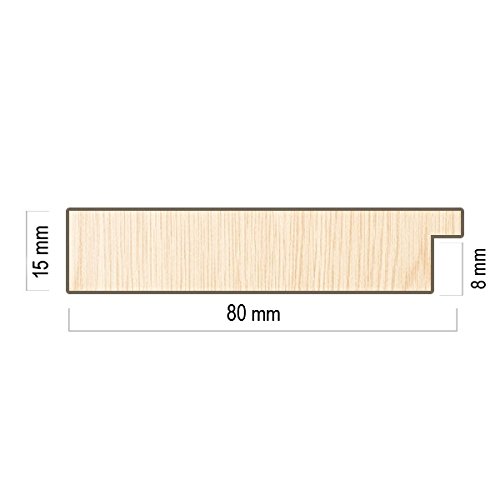
-Espejo Fabricado en España- tamaño 65x165 cm. Espejo Decorativo de Pared Modelo 187 Color Haya, Ideal para baños, dormitorios, Salones, vestidores o entraditas.
- Medida Exterior del marco 65x165 cm, medida de espejo 50x150 cm. Moldura en MDF de 8 cm de ancho, terminada en haya.
- Si desea el marco en otro color, una vez realizada la compra envíenos un mensaje vía Amazon (contactar con el vendedor) indicando el color que desea.
- Espejo de 3 mm nacional, aporta excelentes calidades ópticas y no deforma la imagen como la mayoría de los importados.
- Incluye kit completo con 2 colgadores e instrucciones para colocarlo en horizontal o vertical.
- Está fabricada por nosotros, es un producto hecho en España.


Vans Atwood, Zapatillas para Hombre, Negro (Black/White Canvas 187), 49 EU
- Precio mínimo ofrecido por este vendedor en los 30 días anteriores a la oferta: 57.89€


The Modern Endowment Allocation Model (Wiley Global Finance Executive Select Book 187) (English Edition)


Terapia Cognitivo-Conductual con Mindfulness integrado (Biblioteca de Psicología)


Siku 1866 1:87 Preassembled Truck/Trailer modelo de vehículo de tierra - modelos de vehículos de tierra (1:87, Preassembled, Truck/Trailer, Metal, Rojo, Amarillo) , color/modelo surtido
- Color: amarillo / rojo
- Buen juguete ("Spiel gut") premio
- TÜV (certificado de prueba alemán) a prueba: si

Imágenes de Modelo 187
Aquí tienes un conjunto de fotografías de modelo 187 para que te hagas una idea y puedas escoger entre todos los modelos de perfume. Haz click en en una de las fotografías para ver la ficha completa del artículo y su coste.