Booster de hidrogeno
Nos agrada meditar que el perfume es la cereza encima del helado, el toque final que une tu mirada, gracias a la activación de nuestros sentidos con booster de hidrogeno, que booster o brow booster. Pero no se puede negar que comprar una nueva olor puede ser una experiencia desafiante (sin mentar el dolor de cabeza). Es posible que no salgas tan de forma frecuente como solías hacerlo en estos días, pero el hecho de que hayas dejado de socializar no quiere decir que tengas que dejar de utilizar la mejor colonia. Un aroma es algo que también usas para ti. La fragancia puede cambiar instantáneamente tu estado de ánimo, por lo que con frecuencia procuramos una ya antes de los acontecimientos, así sea en la sala de juntas o bien en un bar. El toque final de cualquier buena apariencia es la confianza para llevarla a cabo, y la forma más veloz de animar esa autoconvicción es un buen rocío de tu aroma favorito. Dado que el olfato es una de las conexiones más poderosas con los centros de placer y los recuerdos de nuestro cerebro, el perfume que escoja no solo puede evocar ciertas emociones en los que le rodean, sino que puede acotar temporadas enteras de su vida.
Listado top ventas para Booster de hidrogeno
En este listado puedes comprar numerosos artículos como booster de hidrogeno magníficos para el cuidado de tu cuerpo. Queremos ayudarte a localizar los mejores modelos, a tener la posibilidad de comparar precios y conseguir la mejor opción para tu bienestar.

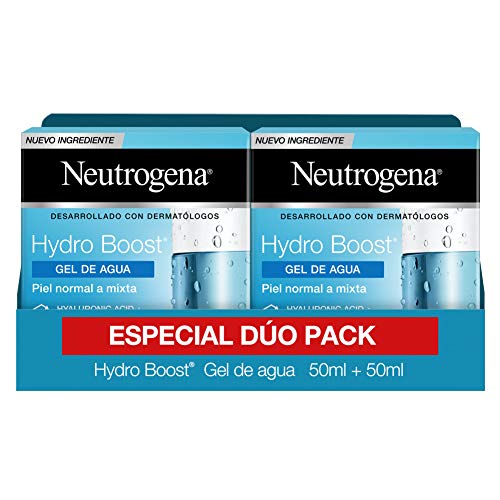
Neutrogena Hydro Boost Rutina de la Crema de Día y Noche, Hyaluronic Acid and Botanical Trehalose, Pack de 2 x 50 ml
- El Gel de Agua Hydro Boost es un gel hidratante que combina una textura ligera con una hidratación continua de larga duración que mantiene la piel hidratada durante todo el día
- Su tecnología Hyaluronic Gel Matrix ayuda a revitalizar la epidermis con un plus de la hidratación, creando una reserva de agua
- Su textura ligera está específicamente recomendada para pieles normales y mixtas, no comedogénica
- La Mascarilla de Noche Hidratante Hydro Boost ha sido desarrollada para evitar la aparición de los signos de fatiga de la piel ya que suaviza las marcas de fatiga
- Su fórmula memory gel de efecto prolongado envuelve tu piel en un fino velo para dejarla más tersa; Su fórmula con ácido hialurónico está libre de aceites, no es pegajosa y no ensucia la almohada

Neutrogena Hydro Boost Gel de Agua, Crema Hidratante Facial para Pieles Normales y Mixtas con Ácido Hialurónico, 2x50 ml
- El Gel de Agua Hydro Boost es un gel hidratante que combina una textura ligera con una hidratación continua de larga duración que mantiene la piel hidratada durante todo el día
- Su tecnología Hyaluronic Gel Matrix ayuda a revitalizar la epidermis con un plus de la hidratación, creando una reserva de agua
- Da como resultado es una piel renovada e hidratada durante todo el día, con una sensación de suavidad y elasticidad
- Su textura ligera está específicamente recomendada para pieles normales y mixtas, no comedogénica
- Descubre toda la gama Hydro Boost de Neutrogena para cuerpo, manos y rostro, y convierte la hidratación en una parte esencial de tu rutina diaria


DAGUAN-YAOYAO Módulo electronico Generador de Alto Voltaje DC 3V-6V bis 400 kV 400000V Boost Paso Arriba un módulo de alimentación de 400 kV
- Entrada: 3.7-6V 4A longitud de la línea de entrada: aproximadamente 10 cm
- Salida: 400KV 0.5A Línea longitud: aproximadamente 8 cm
- De alta tensión de dos polos distancia de descarga: 1 cm - 2 cm
- Acerca de potencia de entrada: sola batería de 3,7 V de litio o dos series, tales como 18650 de la batería, o cadmio de níquel / pila de níquel-hidrógeno, 4V o 6V batería de plomo, etc. (6V batería puede lograr los mejores resultados)


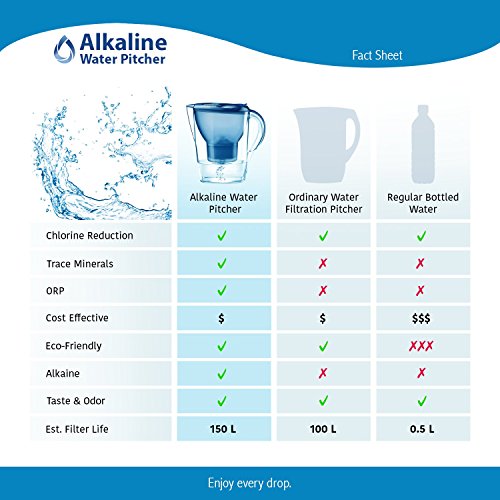
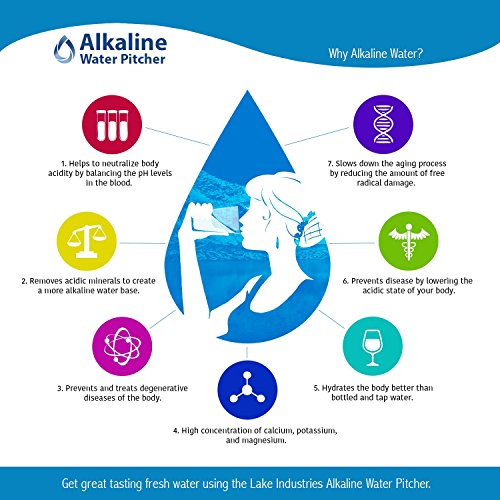
The Alkaline Water Pitcher - 2.5 Liters by Lake Industries
- The Alkaline Water Pitcher - 2.5 Liters
- 2.5L

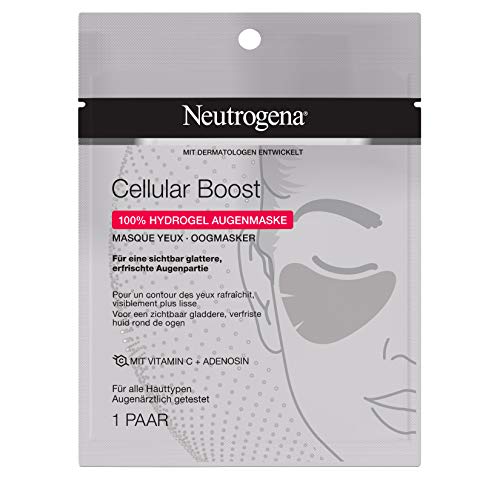
Neutrogena Cellular Boost - Máscara para ojos sin perfume, para una zona de los ojos visiblemente más lisa y refrescante
- Para una zona de los ojos visiblemente más lisa y refrescante: Neutrogena Cellular Boost máscara con vitamina C (derivados de vitamina C) y adenosina, adecuado para todos los tipos de piel.
- Mascarilla 100% de hidrogel: suaviza las líneas finas y se ajusta como una segunda La piel del contorno de los ojos para maximizar la absorción de ingredientes importantes.
- El resultado después de tan solo 15 minutos: el contorno de los ojos se siente más suave y refresca - Ayuda a contrarrestar los signos de cansancio
- Aplicación: limpiar la cara, quitar la lámina protectora y colocar la máscara de ojos con la cara lisa hacia abajo bajo el ojo, dejar actuar 15 minutos, quitar la máscara y masajear suavemente los residuos.
- Contenido del envío: 1 x Neutrogena Cellular Boost máscara de ojos 30 ml


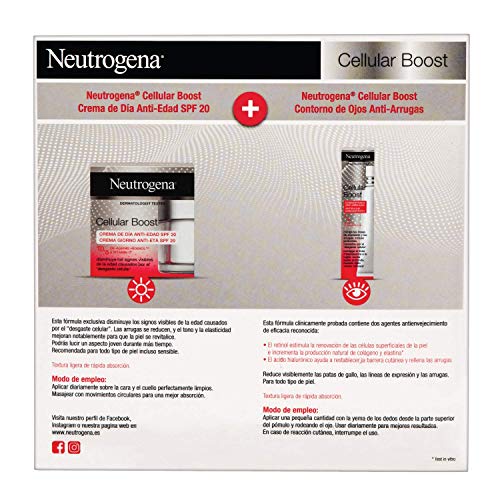
Neutrogena Cellular Boost Anti-edad, Pack Crema de Día SPF20 + Contorno de Ojos Anti-arrugas Rejuvenecedor
- La crema de día reduce las arrugas y protege contra los daños causados por el sol con un factor de protección solar 20
- Gracias a la eficaz composición de la crema hidratante, se mejora la elasticidad de la piel y se reducen las arrugas - combate el 'agotamiento celular'
- Aplicar diariamente la crema sobre la cara y el cuello perfectamente limpios; masajear con movimientos circulares para una mejor absorción; para mejores resultados, aplicar dos veces al día
- El contorno de ojos anti-arrugas corrige las patas de gallo, las líneas de expresión y las arrugas causadas por "desgaste celular"
- Aplicar una pequeña cantidad del contorno de ojos con la yema de los dedos desde la parte superior del pómulo y rodeando el ojo; usar diariamente para mejores resultados


Neutrogena Hydro Boost Loción Corporal en Gel - Pack de 2 x 750 ml - Total: 1500 ml
- Clínicamente probada para una piel más elástica y radiante
- Su fórmula refrescante y ultraligera está enriquecida con ácido hialurónico
- Textura no grasa que se absorbe al instante, para que no tengas que esperar a vestirte
- Adecuada para pieles sensibles


Neutrogena Hydro Boost Loción Corporal En Gel - 400 ml.
- Hidrata al instante y de forma continua
- Refrescante, ultraligera, y no grasa
- Para una piel más elástica
- Loción corporal indicada para piel normal, seca. Incluso sensible
- 0


Neutrogena Cuidado Facial, mascarilla de noche hidratante - 50 ml
- Enriquecida con ácido hialurónico
- Reduce los signos visibles de agotamiento celular
- Libre de aceites
- Aplicar cada noche sobre el rostro y el cuello


Neutrogena Hydro Boost Mascarilla de Noche Hidratante - 50 ml.
- Rehidrata noche tras noche aumentando la resistencia de la piel a la deshidratación, refuerza la resistencia a la pérdida de agua de la barrera cutánea
- La crema con ácido hialurónico fortalece la barrera protectora de la piel y combinada con una fórmula de gel suavizante con efecto memoria, reduce los signos de fatiga y la deshidratación
- Suaviza las marcas de fatiga: su fórmula memory gel de efecto prolongado envuelve tu piel en un fino velo para dejarla más tersa
- Tratamiento facial sencillo y resultados al instante: aplicar cada noche sobre el rostro y el cuello, la piel se rehidrata y el efecto permanece durante 24 horas
- Contenido del envío: 1 x Neutrogena Hydro Boost Mascarilla de Noche con hidratación duradera y no grasa, 50 ml


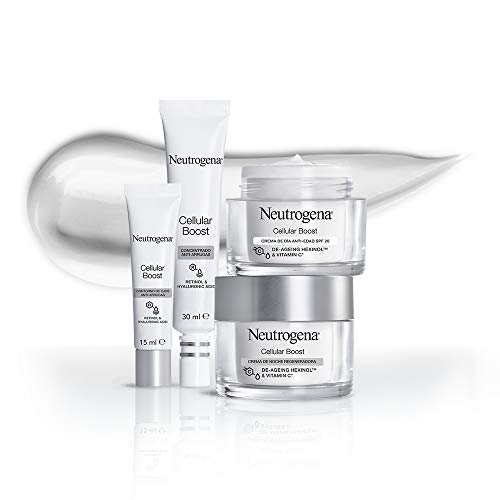
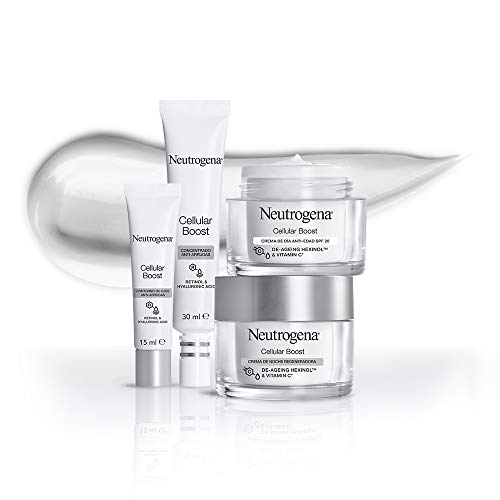
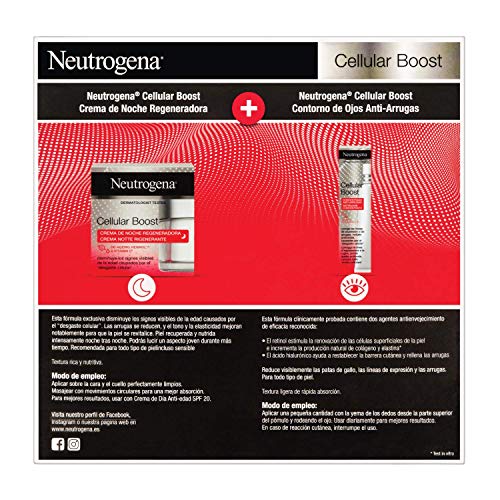
Neutrogena Cellular Boost Anti-edad, Pack Crema de Noche Regeneradora + Contorno de Ojos Anti-arrugas Rejuvenecedor
- La crema de noche disminuye los signos visibles de la edad causados por el "desgaste celular"; se reducen las arrugas y el tono y la elasticidad mejoran notablemente
- Piel recuperada y nutrida intensamente noche tras noche; podrás lucir un aspecto joven durante más tiempo
- Aplicar diariamente la crema sobre la cara y el cuello perfectamente limpios
- El contorno de ojos anti-arrugas corrige las patas de gallo, las líneas de expresión y las arrugas causadas por "desgaste celular"
- Aplicar una pequeña cantidad del contorno de ojos con la yema de los dedos desde la parte superior del pómulo y rodeando el ojo; usar diariamente para mejores resultados


Neutrogena Crema Facial En Gel Hydro Boost (Para Piel Seca) - 50 ml.
- Mima tu piel con una dosis de hidratación y nutrientes, cuida tu rostro a diario con esta crema de gel para cuidado facial y conseguirás un aspecto totalmente renovado
- Su rica textura con su plus de hidratación hacen de este Hydro Boost crema de gel un producto perfecto para mantener una piel cuidada, nutrida y no grasa
- Si tienes una piel seca, este hidratante contiene los ingredientes necesarios para una hidratación y nutrición intensas y de larga duración; Sin perfume;
- Aplicar diariamente sobre la piel del rostro y cuello después de la limpieza diaria, realizar movimientos circulares para una mejor absorción
- Contenido del envío: 1x Neutrogena crema de gel Hydro Boost con hidratación duradera para pieles secas con fórmula no grasa, 50 ml

Imágenes de Booster de hidrogeno
Aquí tienes una serie de imágenes de booster de hidrogeno para que te hagas una idea y puedas escoger entre todos los modelos de perfume. Pincha en en una de las fotografías para ver la ficha completa del artículo y su valor.