Lumiere estudio
Por suerte los maestros de la fragancia han hecho que descubrir el perfume ideal sea un poco más simple que conjuntarlo con la cita perfecta. Después de buscar en los archivos de perfumes ciertas más populares y también interesantes, encontramos esencias con un probado historial de intriga que han dado sitio a referencias tales como lumiere estudio, menta estudio valencia o bien lumiere. Si eres una persona que no actualiza su fragancia tan con frecuencia como debería (no te estamos juzgando) puede que te resulte interesante saber que si guardas tu colonia en el baño, donde está expuesta al calor, al vapor y a la humedad (gracias por nada, en la ducha), rompe absolutamente las notas y dejándola, bueno, por lo general mohosa. Cambiamos nuestra colonia prácticamente tanto como cambiamos nuestro vestuario. Quieres asegurarte de que tu olor deje una marca en todos y cada uno de los que te rodean. Sin ser demasiado abrumador. La colonia ha avanzado mucho a lo largo de los años y hay tantas opciones basadas en tus olores favoritos, tu personalidad, la temporada del año e incluso la hora del día en que piensas utilizarla.
Listado top ventas para Lumiere estudio
Avanza por esta relación de singulares productos como lumiere estudio, lo mejor para cuidar a tu bienestar. Vamos a ayudarte a localizar los mejores modelos, a poder comparar precios y alcanzar la mejor opción para tu cuerpo.

Simone de Beauvoir's Little Book of Selected Quotes: on Life, Women, and Philosophy


Fiche de lecture Qu'est-ce que les Lumières ? (Étude intégrale)


Oeuvres complètes: Tome 1, De l'esprit (L'âge des lumières)


Neewer Flash de estudio, paraguas octagonal, macro/anular ventana de luz Softbox, con bolsa de transporte, para fotografía de retrato o de producto, 32 pulgadas / 80 cm, negro y plateado
- El diámetro de la superficie de difusión de luz es 32
- Se trata de una ventana de luz cuando se propaga y como un paraguas cuando está plegada, fácil de usar.
- El cuerpo de paraguas es hecha de material de nylon de alta densidad, alta reflexión.
- Doble marco metálico, ligero y sólido.
- Se puede utilizar con los flashes y algunas luces de flash de estudio con orificio de paraguas.


Les Lumières catholiques à Fribourg: Trajectoires et actions réformatrices des prêtres éclairés Charles-Aloyse Fontaine et Grégoire Girard (French Edition)


SHOTFOTO 60x60x60cm Caja de Fotografía Portátil Plegable Photo Studio Light Box Estudio Fotográfico luz Regulable de 120 LED con 6 Fondos de Colores y Bolsa de Transporte y Trípode
- Versión mejorada de 60 cm: equipado con luces regulables sin estroboscópicas 2x 60LED que garantizan una iluminación suficiente. Es muy fácil obtener imágenes de alta calidad debido a que no hay luces LED estroboscópicas, incluso si está utilizando un teléfono móvil para fotografiar. También viene con un trípode de teléfono para ayudarlo a obtener mejores imágenes.
- Diseñado para profesionales: la luz puede llenar fácilmente toda la tienda debido a su alto forro reflectante que hace que la luz sea perfecta para cualquier artículo para que pueda obtener una mejor foto que nunca. El cuerpo de 24 pulgadas / 60 cm lo hace adecuado no solo para artículos pequeños sino también para artículos de mayor tamaño. Con un agujero redondo en la parte superior, podría obtener diferentes ángulos para fotografiar.
- Brillo regulable: incorporado con atenuador continuamente ajustable para que pueda cambiar el brillo de 0% a 100%, lo que le ayuda a encontrar el mejor aspecto de sus artículos. Viene con un paño difusor para suavizar la luz cuando se toman fotos profesionales para artículos que tienen una superficie deslumbrante.
- Más fácil para ti: todo el conjunto está doblado en el tamaño de una bolsa. Todo lo que necesita hacer es desplegarlo y comenzar a usarlo. No hay otra operación y puede usarlo en 30 segundos después de recibirlo. La conexión de velcro facilita el montaje y desmontaje.
- Mejor que nunca: viene con 6 fondos de colores diferentes (blanco / negro / naranja / rojo / verde / azul) que se adapta a más escenas diferentes. El servicio de 5 estrellas las 24 horas lo ayuda con su problema. Cualquier problema de calidad lo reemplazaremos o reembolsaremos. Siéntase seguro para comprar nuestros productos.


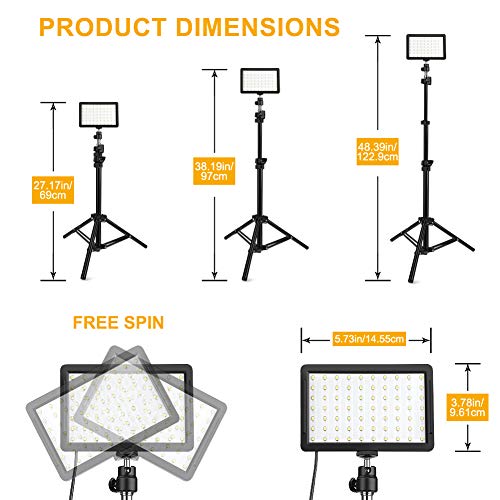
Obeamiu 3 luces LED vídeo con soporte ajustable trípode, color filtros, 5600K USB iluminación estudio para tableta/disparo ángulo bajo, YouTube
- [Múltiples niveles de color y brillo]: 360 ° Full Color hará que su fotografía sea más colorida. El panel de luz LED adopta 70 piezas de cuentas LED, iluminancia de hasta 1100Lux (0.5M). Utilice perlas de lámpara de índice, CRI≥97, TLCI≥97, RA≥97 para proporcionar una fuente de luz más realista para su toma y puede iluminar sus videos o imágenes.
- [Control de iluminación]: iluminación perfecta fácil de configurar. Simplemente presione el botón en el cable USB para cambiar de modo y ajustar el brillo en otros modos. Ajuste de brillo preciso del 10 al 100%. Conveniencia para controlar la temperatura de color precisa. Los 4 filtros de color se instalan para efectos creativos de diferentes colores de luz y brindarán diferentes experiencias visuales.
- [Soporte de trípode versátil y portátil]: el trípode Obeamiu, que no se gira para bloquear con el tiempo, adopta cierres rápidos y una base de trípode con peso para una mayor estabilidad para que no se vuelque. Se extiende de 27.17 '' a 48.39 '' y está hecho de aluminio de alta calidad, se puede ajustar a cualquier longitud para satisfacer sus necesidades. La materia del poste de extensión está hecha de aleación de aluminio, es duradera y no es fácil de romper.
- Esta luz de video LED profesional mejorada es adecuada para sus actividades fotográficas. Las tres luces de video LED pueden alcanzar la misma altura de 48,39 pulgadas. Se puede usar ampliamente para el control de iluminación de fotografías y videos y se adapta a varios escenarios, ya sea transmisión en vivo, toma de retratos, maquillaje de belleza, toma de videos de YouTube o luz de relleno para diferentes entornos.
- [Listas de paquetes]: 3 * Panel de luz LED USB con cable, 3 * Gimbal universal, 3* control remoto, 3 * Soporte para trípode, 3 * 4 filtros de color (amarillo / rojo / azul / blanco). Perfecto para su video de Youtube, estudio, entrevista, vlog, iluminación de fotografía. Bienvenido a enviarnos un correo electrónico cuando tenga preguntas.


FOSITAN Caja de Fotografía 90*90cm/35"Caja de Luz Estudio fotográfico portátil, 126 LED Luz de Día 15000LM Foto Estudio con 2 tiras de LED, 4 fondos (blanco, negro, naranja, azul), bolsa de transporte
- Excelente Photo Box actualizado: Cuentas de luz LED dobles de 126 piezas con 15000LM, súper brillantes para proporcionar la fuente de luz adecuada. The service life of the light beads is 50000H. The LED with high Color Rendering Index (CRI 95+) provide with natural and vivid shooting effects.
- Dimensión de la tienda de tiro: 35 "x35" x35 "/ 90cmx90cmx90cm. La tienda de fotografía se compone de tela reflectante. La luz emitida por las perlas de luz se distribuye de manera más uniforme en cada esquina de la caja de fotos bajo el efecto de la pared interior reflectante, haciendo que la caja sea más brillante y más uniforme. Ideal para fotografía de objetos pequeños a grandes.
- Fondos de 4 colores opcionales: Esta caja de luz LED profesional viene con 4 fondos (blanco / negro / naranja / azul), por lo que puede cambiar fácilmente los colores de fondo y crear varios efectos de disparo según sea necesario. Solo necesita arreglar el papel de fondo en la ranura superior e inferior.
- Disparo multiángulo y fácil instalación: Puede abrir la caja de luz de 4 formas / ángulos para disparar objetos y disfrutar de diferentes ángulos de fotografía profesional. El marco de la carpa ligera está configurado por convenientes juntas. Y el cuerpo de la tienda está construido con cremalleras de actualización. No se necesitan otras herramientas para la instalación y desmontaje.
- Brillo ajustable: El brillo se puede ajustar de forma gradual y estable del 10% al 100% sin parpadeo ni distorsión. Temperatura de color 5500K. Sin luz estroboscópica, lo que le permite tomar imágenes de alta calidad en diferentes fondos con cualquier teléfono o cámara.


La Bible, le Coran et la science : Les Écritures saintes examinées à la lumière des connaissances modernes


Les mouvements littéraires - Le classicisme, les Lumières, le romantisme, le réalisme et bien d'autres (Fiche de révision): Réussir le bac de français (LEPETITLITTERAIRE.FR) (French Edition)


Ramses 1: Le fils de la lumiere: Le Fils De La Lumiere 1 (Pocket)
- Used Book in Good Condition


Spiritual Enlightenment Stories In English and French: Histoires des Lumières spirituelles, En anglais et en français (French Edition)

![La Lumière Dans Les Ténèbres [Explicit] La Lumière Dans Les Ténèbres [Explicit]](https://www.iesribera.es/pics/2020/10/01/la-lumiere-dans-les-tenebres-explicit-197138.jpg)
La Lumière Dans Les Ténèbres [Explicit]


Los cuadernos inéditos de Berlanga: 1 (Pigmalión Lumiere)


Un soudain éclair de lumière A Sudden Burst of Light: Histoire bilingue - Niveau Intermédiaire Bilingual Story - Intermediate level (1 HISTOIRE BILINGUE 1 BILINGUAL STORY t. 3) (French Edition)

![La Lumière Dans Les Ténèbres [Explicit] La Lumière Dans Les Ténèbres [Explicit]](https://www.iesribera.es/pics/2020/10/01/la-lumiere-dans-les-tenebres-explicit-197135.jpg)
La Lumière Dans Les Ténèbres [Explicit]


Profil - Jacottet : A la lumière d'hiver: Analyse littéraire de l'oeuvre

Imágenes de Lumiere estudio
Si lo que quieres es elegir de forma visual los productos, puedes ver aquí un conjunto de fotografías de lumiere estudio. Pincha una de las imágenes y pasarás a la compra online de colonia en concreto viendo sus propiedades y precio.