Look completo online
Cuando se está a la caza del aroma perfecto, es bastante difícil juzgar lo que resulta conveniente con sólo olfatear la botella. Una buena fragancia debe tener un equilibrio entre los aromas complementarios, la longevidad y uno que coincida con su personalidad. Los aceites esenciales aportan más que los sintéticos en términos de longevidad y equilibrio. Valora lo que realmente te agrada y consíguelo con la compra de look completo online, estuche de maquillaje completo o licor del polo completo. La mayoría de las mejores colonia y olores para mujeres y hombres pueden ser compradas en línea, sin embargo, recomendamos probarlas primero en la tienda. Salpicar un tanto en la tienda, entonces ir a dar un paseo y ver de qué manera huele después de 15 minutos. La mayoría de las colonias huelen diferente en cada uno. Tu piel y las feromonas reaccionan con la poción para personalizar el aroma, lo que significa que no tienes que ponerte miles en una colonia adaptada para lograr algo único. Si eres una persona que no actualiza su fragancia tan de forma frecuente como debería (no te estamos juzgando) puede que te resulte interesante saber que si guardas tu colonia en el baño, donde está expuesta al calor, al vapor y a la humedad (gracias por nada, en la ducha), está rompiendo absolutamente las notas y dejándola, bueno, por norma general mohosa.
Listado top ventas para Look completo online
Te mostramos nuestro listado de productos gracias al cuál encontrarás look completo online que se ajusten a los requisitos de tu bienestar. Encontrarás numerosas referencias de diferentes modelos con buena calidad y con predio competitivo para todo lo que requieres para.

Learn How to Play Indian Raga Scales on your Guitar: A complete look at Raga scales, fret board patterns and techniques, with examples.


Ethical Hacking: The Complete Beginners Guide to Basic Security and Penetration Testing (Networking Basics and Ethical Hacking for Newbies)


LINUX FOR HACKERS: LEARN CYBERSECURITY PRINCIPLES WITH SHELL,PYTHON,BASH PROGRAMMING USING KALI LINUX TOOLS. A COMPLETE GUIDE FOR BEGINNERS (HACKERS ESSENTIALS Book 1) (English Edition)


NIKE FC Barcelona Temporada 2020/21-FCB LK NK BRT HMCD4590-456 Kit Completo Primera Equipación, Niño, Deep Royal Blue/Varsity Maize Full Sponsor, S
- Soccer set
- Tejido transpirable
- Material: 100% poliéster
- Fcb lk nk brt kit hm
- Tela suave
- Tipo de deporte: atletismo


Complete First Student's Book without Answers with CD-ROM Second Edition

Color Atlas of Veterinary Anatomy, Volume 3, The Dog and Cat, 2e


Fresh Paint: Discover Your Unique Creative Style Through 100 Small Mixed-Media Paintings


Flower Color Guide


I Will Teach You Excel: Master Excel, surpass your co-workers, and impress your boss! (English Edition)


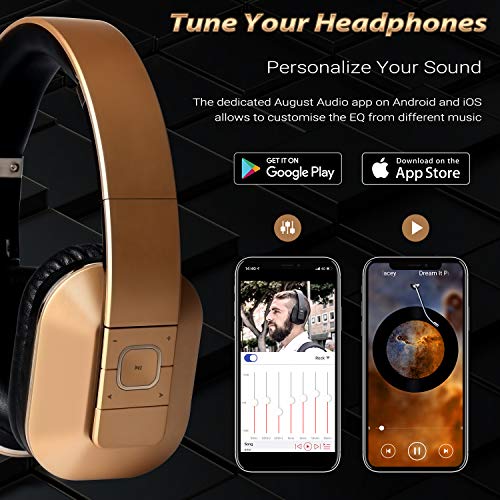
August EP650–Auriculares Bluetooth Inalámbrico–Auriculares Diadema Casco Plegable-Sonido Estéreo Bass Rich-Auriculares Orejeras Cómodas con NFC y aptX,Color Dorado
- SONIDO ESTÉREO RICO-Le permite disfrutar de una música clara BASS RICH con DEFINED TREBLE desde su teléfono, estos auriculares utilizan unidades drive 50mm para proporcionar un sonido de calidad optimizada desde cualquiera fuente.
- DISEÑO DE ÓPTIMA COMODIDAD-Le permite disfrutar de la óptima comodidad, LIGHTWEIGHT, con relleno rico y lujoso, diadema extensible y orejeras cómodas flex, será un placer poner estos auriculares over-ear, incluso por un día completo.
- BLUETOOTH V4,2 APTX LOW LATENCY PARA AUDIO Y VIDEO SYNC-Le permite disfrutar de sus programas TV y películas favoritas sin molestar a los demás, estos auriculares Bluetooth aptX LL se conectan a su TV o transmisor Bluetooth en segundos, sin demoras notables entre imagen y sonido.
- CONEXIÓN BLUETOOTH RÁPIDA-Simplemente por tocar su teléfono al conector NFC o a través de la sincronización para escuchar sus músicas favoritas en segundos. Para dispositivos No Bluetooth, se puede utilizar entradas de audio USB y Estándar 3,5mm, son auriculares de amplia compatibilidad.
- SONIDO PERSONALIZABLE-Puede utilizar la aplicación Android o Apple AUGUST AUDIO EQ para ajustar estos auriculares Bluetooth de acuerdo con su interés personal, sus unidades drive pueden reproducir cualquieres sonidos sin perder la fidelidad.


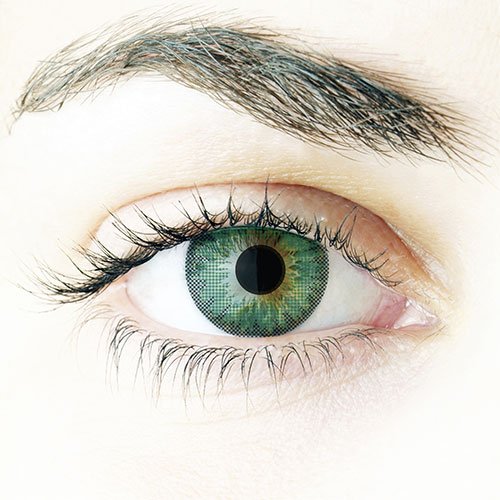
Fresh Look Dimensions Mes lente suave
- coloreada mes lentes aportan sus ojos nuevo color
- Luminoso Para ojos
- Especialmente luminoso ojos dar Fresh look Dimensions mes lentes una misteriosa intensidad y profundidad y sus mirar una dimensión completamente
- La oscura Iris Anillo puede luminoso ojos más grande, flamante y aspecto Discípulos


DELIMIRA - Sujetador Reductor Copa Completa con Aros Minimizador para Mujer Beige 100E
- Sujetador copa completa con aros para una gran sujecion
- Encaje detalles decorativos para un look femenino
- Tirantes ajustables, acolchados y antideslizantes


TExES Core Subjects EC-6 291 Book: TExES Study Guide & Practice Test Questions for the Texas Examinations of Educators Standards (291)


Mastering Bitcoin 2e: Programming the Open Blockchain


The Book Thief: The life-affirming number one international bestseller (English Edition)

Imágenes de Look completo online
Si prefieres elegir de forma visual los artículos, puedes ver aquí una agrupación de fotos de look completo online. Pincha con el ratón una de las fotografías y pasarás a la adquisición online de colonia en concreto viendo sus características y valor.