Sobre originales
A todos nos agrada oler bien. Puede hacer que tu día sea perfecto. En nuestros días las fragancias son muy importantes en tanto que no solo combaten el fragancia corporal, sino que también ayudan a aumentar la confianza. Oler el placer tiene otros beneficios asimismo, como la reducción del agobio y los efectos del insomnio. Prueba con sobre originales, sobre loreal o sobre raisin y mejora tus experiencias. La mejor colonia para hombres o bien mujeres debe ser cuidadosamente emparejada con las situaciones y ocasiones concretas en las que se empleará. Los seductores aromas oscuros, de tabaco y madera se adaptan a los eventos nocturnos, al tiempo que las fragancias más frescas o bien cítricas marchan mejor para el empleo diario y la oficina. No tengas temor de tomar ciertos riesgos y mudar tu olor favorita de vez en cuando. Pero, ¿qué es lo que significa todo esto verdaderamente? Aprende a escoger la colonia conveniente para ti aquí.
Listado top ventas para Sobre originales
Echa un vistazo por este listado de distintos productos como sobre originales, lo mejor en el cuidado de tu cuerpo. Queremos ayudarte a encontrar los mejores modelos, a poder comparar precios y alcanzar la mejor opción para tu salud.

SiempreClean | Gel Hidroalcohólico En Sobres Individuales | Gel Higienizante Suave Con La Piel | 73% De Alcohol Etílico | Perfume | Sobres X 1 Ml, Original, Perfume Original, 100 Mililitro
- ✔️ Gel desinfectante hidroalcohólico
- ✔️ Textura fresca y olor agradable
- ✔️ Contiene más del 73% de alcohol etílico
- ✔️ Perfecto para llevarlo siempre contigo sin ocupar espacio
- ✔️ Suave con la piel, incluso después de un uso continuado


30 Piezas Vintage Kraft Cinta Sobres MOOKLIN Regalo Sobres de Tarjeta de Boda Fiesta Oficina (tamaño:17.2 x 12.5 cm) - Cinta marrón
- 💕 Papel kraft reciclado de alta calidad con estilo retro.
- 💕 Perfectamente para invitaciones de boda de arte DIY, cumpleaños o tarjetas de felicitación, letras hechas a mano.
- 💕 Tamaño: aprox. 17.2 x 12.5CM.
- 💕 Sobres premium con lindo lazo, adecuados para cualquier ocasión.
- 💕 Paquete de 30, cada sobre tiene una cinta. No hay tarjetas incluidas.


Cartas Pokemon 360 Cartas Espada y Escudo Cielos Evolutivos en Español (178-51204) Sobres Pokemon - Cartas Originales
- Juego de cartas coleccionables de Pokemon Espada y Escudo Cielos Evolutivos de 36 sobres (CADA SOBRE INCLUYE 10 cartas, TOTAL 360 CARTAS)
- Juego de cartas coleccionables de Pokémon en CASTELLANO.
- Siente la fuerza de los vientos cambiantes y prepárate para una tormenta épica con el retorno triunfal de los poderosos Pokémon de tipo Dragón.
- Rayquaza VMAX lidera el grupo desde las alturas, mientras que Duraludon VMAX domina el terreno en su forma Gigamax, acompañados de Dragonite V, Noivern V y muchos más. Cuando las nubes se disipan, las Evoluciones de Eevee emergen en medio de un arcoíris repleto de Pokémon V y Pokémon VMAX, ¡señalando la llegada de un nuevo y luminoso día con Espada y Escudo-Cielos Evolutivos de JCC Pokémon!
- Vuelven los Pokémon de tipo Dragón con una nueva apariencia. Más cartas nuevas de Golpe Brusco y Golpe Fluido.
- Regalo perfecto para los FAN de POKÉMON!


50pcs Sobre de papel Kraft,Creativo retro Sobre en forma de corazón lindo, para la boda, fuentes del regalo de la fiesta de cumpleaños (17.5cmx11.5cm)
- Sobres de papel Kraft de 50 piezas: la mayor parte de los sobres se puede usar para una mayor longevidad. Puede satisfacer sus diferentes necesidades. Puede hacer bricolaje en el frente para crear fundas y sobres con su propio estilo y lo hace lucir elegante.
- Material de alta calidad: estos sobres están hechos de papel kraft de 150 g de espesor, rígido y resistente, de agradable grosor y no se doblarán fácilmente.
- Suministros de bricolaje: las cubiertas de estos sobres están en blanco, y son buenos para suministros de bricolaje, puede dibujar cualquier imagen o escribir cualquier cosa que desee decir
- Aplicación única: Kraft Paper Envelope puede almacenar pequeños artilugios, como cadenas de bisutería, abalorios, colgantes, fotos, broches para pinzas para el cabello, clips, monedas, etc.
- Buen almacenamiento para la tarjeta: bueno para personalizar tarjetas de regalo, notas de agradecimiento, boda o fiesta de cumpleaños, tarjeta de felicitación, mensaje, tarjeta de Navidad, tarjetas de visita


ColaCao Original: Con Cacao Natural - 50 Sobres De 18G
- 50 sobres de 18 gramos por envase "faro"; ideal para el sector hostelero, bares, restaurantes
- El ColaCao de siempre, eso tan tuyo; con cacao natural que se mezcla con el resto de ingredientes sin añadir aditivos; ideal para cualquier momento: desayuno, merienda, cena o como snack
- Su sabor y característicos grumitos se deben al origen de su cacao natural y porque no contiene aditivos
- Con cacao certificado UTZ; al comprar cacao UTZ, ColaCao apoya el cultivo sostenible de cacao; los agricultores certificados por UTZ implementan mejores prácticas agrícolas, con respeto a la gente y al planeta
- Alérgenos: contiene trigo y cebada; mantener en lugar fresco y seco


Un Curso Sobre Milagros Edición Original Comentada


Papá escribí un libro sobre ti: Contiene frases para completar, razones por las que mi PAPÁ es el mejor para escribir, Lugar para fotos y dibujos. día del padre cumpleaños regalo original


Sobre, Sobres Pequeños, 20 Piezas Sobres Forma Corazón, Multicolor Sobres, Sobres Adorables, Invitación Sobres, Sobres Regalo, Sobres de Colores, para Fiestas, Bodas, Navidad (5 Colores)
- Material de Papel Premium: Los mini sobres de papel perlado de colores están hechos de material de papel perlado premium, lo que los hace resistentes, duraderos y relucientes. El papel resistente puede proteger sus tarjetas o palabras de la deformación.
- Juego de Sobres Multicolores: El paquete incluye 5 sobres de colores mini. Hay 5 hermosos colores en total, incluyendo bronce dorado, oro blanco, rosa, fucsia y verde oscuro. Una variedad de colores satisface sus diferentes necesidades.
- Diseño Exquisitamente Elegante: El sello de los sobres de colores está diseñado con un borde de arco suave y un lindo broche de corazón. El diseño exquisito lo hace muy elegante, elegante y especial.
- Amplia Aplicación: Estos mini sobres coloridos son adecuados para tarjetas de regalo personalizadas, invitaciones, tarjetas de felicitación, tarjetas de Navidad, etiquetas de regalo y también pueden almacenar pequeños dispositivos, como cadenas de joyas, cuentas, colgantes, fotos, horquillas para el cabello, monedas y pronto.
- Nota Cálida: Por favor, péguelos con cinta adhesiva o pegamento en barra si necesita sellarlos porque estos mini sobres coloridos no son autoadhesivos (cinta, pegamento o barra de pegamento no están incluidos)


10 tarjetas para rascar con sobres, tarjetas de felicitación, anuncio de embarazo, bodas, invitaciones, regalos personalizados, San Valentín, cumpleaños y aniversarios.
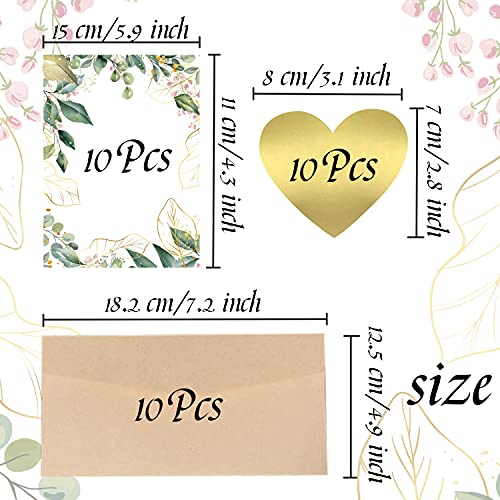
- 💌 【10 tarjetas para rascar de bricolaje】 10 piezas de tarjetas para rascar de 15 * 11 cm / 5.9 × 4.3 ", 10 sobres de papel kraft y 10 pegatinas para tarjetas de rascar de color dorado.
- 💌 【Sorpresa única】 Diseño personalizado, puede usar su imaginación para diseñar su tarjeta de rascar y llevar amor y sorpresa a sus amigos y familiares.
- 💌 【Múltiples ocasiones】 Adecuado para todas las ocasiones: tarjetas de felicitación, anuncio de matrimonio, anuncio de embarazo, divulgación del género del bebé, invitaciones, cumpleaños, día de San Valentín, aniversarios.
- 💌 【Fácil de crear】 Escriba su texto, alinee el texto y pegue el corazón de amor dorado en él. El destinatario simplemente raspa el recubrimiento con una uña o una moneda y usted puede prepararle una sorpresa.
- 💌【Buenos recuerdos】 El patrón está claramente impreso y se utilizan 300 g de papel estucado para mantener los buenos recuerdos entre ustedes.💌Nota: el texto de la tarjeta de rascar lo escribe usted con un bolígrafo, no lo imprime el fabricante. ¡Escribe el texto y envía amor!


SLOSH 20 Tarjeta Kraft Felicitacion Cumpleaños Bebe Regalo y Sobres Tarjeta Navidad Boda Felicitación Papel (20 pcs)
- ❤20pz Tarjetas Felicitación ❤ 9 estilos bonitos flores hechas a mano para secar (girasol, claveles púrpuras, cala, flor de cuentas, rosas, margarita)
- ❤ El paquete incluye: tarjetas de felicitación de 20 piezas (cada sobre incluye 1 sobre, 1 tarjeta, 1 flor, 1 cuerda de yute, 1 pegatina). "Dejar tiempo para decir" gracias "o expresar su aprecio es una parte importante de las relaciones. Envíe estas tarjetas de agradecimiento a alguien que sea especial para usted. El mejor regalo de la fiesta o cumpleaños.
- ❤Material: papel kraft hecho a mano de alta calidad con decoraciones de flores secas. Tamaño: el sobre es de 17.5 * 11 cm, el papel es de 15.5 * 10.5 cm.
- ❤ "Dejar tiempo para decir" gracias "o expresar su aprecio es una parte importante de las relaciones. Envíe estas tarjetas de agradecimiento a alguien que sea especial para usted. El mejor regalo de la fiesta o cumpleaños.
- ❤ Advertencia: Las flores falsas pueden aplastarse durante el transporte. Es necesario reorganizarlos para restaurar la belleza.


Baila Pogo Sobre un Nazi (original)


Bi Roix
- Juega contra el ordenador. La dificultad se adapta a tu experiencia
- Distintas variaciones de ajedrez: Silverman, Gardner, Los Alamos, Baby... y ajedrez clásico
- Puzzles de jaque mate en 1 o 2 movimientos
- Niveles con limitación de tiempo por turno
- Modo historia guiado por una épica aventura
- Modo libre para seleccionar fácilmente tus niveles favoritos
- Editor web de niveles. Crea tus niveles y compártelos con tus amigos
- Control adaptado a teclado, raton y gamepad
- Traducido a inglés y español


Sobre Paixao (Original Mix)


JZK 50 x Sobre tarjetas regalo papel kraft en blanco caja bolsa para cd, dvd, fotos instantáneas, favor de fiesta bolsas cajas para bodas cumpleaños navidad baby shower graduación
- Paquete incluido: 50 x caja de cd kraft. Material: Papel kraft duradero. El tamaño del producto terminado: 12.9 x 12.9 x 1.5 cm.
- La cubierta de estos sobres está en blanco, cada sobre tiene un cierre en forma de corazón para el cierre, muy bonita y elegante.
- Sobre de papel de Kraft del vintage, perfecto para marcadores de posición de boda, suministro de tarjeta de regalo de fiesta de cumpleaños / navidad, tarjetas vacaciones, invitaciones boda, etiquetas recepción o notas de bricolaje del día de san valentín.
- Este caso kraft Ideal para llevar CD, DVD, fotos instantáneas, fotos instantáneas polaroid, Fujifilm fotos instantáneas, pequeño regalo plano y pequeñas joyas, etc.
- Este caso favorece es muy delicado, hermosa y elegante. ★Necesitas ensamblarlos tú mismo, pero no te preocupes, son muy fáciles de montar.


Pluma de Escritura, Joylink Antique Feather Pen Punta Vintage Pinta de Inmersión Metálica 5 Consejos Diferentes, Sobre Vintage, Una Botella de Tinta, Papel Con Membrete y Caja Exquisita (Pluma Negra)
- ❤Diseño especial - Cabezal de pluma tallado de alta calidad que proporciona un control y una estabilidad superiores, lo que proporciona suavidad y un fácil flujo de tinta. Nuestro bolígrafo de escritura tiene un aspecto único y brillante que puedes imaginarte sumergiendo un elegante bolígrafo en tinta y escribiendo trozos de notas hacia la vida, colocándolo suavemente en un sobre liso, qué feliz es esto.
- ❤Tinta para botella / Plumillas - Este juego tiene 5 tamaños diferentes de plumilla para satisfacer sus diferentes necesidades y 15ml de tinta líquida incluida. Puede escribir 20-30 letras en inglés o 20-25 caracteres chinos después de sumergir la tinta una vez.
- ❤Materiales de alta calidad - la pluma es una pluma de inmersión hecha a mano y elegante, que mezcla acero inoxidable con aleación de iridio para evitar la oxidación y garantizar la durabilidad. El diseño liviano hace que la pluma de inmersión sea cómoda de sostener.
- ❤Set completo - Este set de bolígrafos antiguo incluye un bolígrafo de tinta de alta calidad (con un plumín), plumillas reemplazables, tinta de bolígrafo líquido, base de plumillas, sobres, papeles de escribir, cuerdas, accesorios metálicos. La pluma de pluma perfecta satisface sus diferentes necesidades y le brinda diferentes experiencias de vida.
- ❤Mejor regalo - El diseño exquisito, el estilo antiguo, la fabulosa belleza de las artes de cada pluma de pluma contiene el trabajo duro de un artesano. Esta pluma de caligrafía es un regalo decente de alto grado y significativo para su familia y amigos en Navidad, Día de Acción de Gracias, cumpleaños, etc.


Sol de Medianoche (Saga Crepúsculo 5)


ZeWoo Tarjeta de Felicitación, Papel Kraft Retro Hecho a Mano, Sobres en Blanco, Flores Secadas Postal Decorada para Persona Especial y Ocasión Importante
- ❤ Material: Papel
- ❤ Tamaño: El sobre es 17.5 * 11cm, La tarjeta es 15.5 * 10.5cm.
- ❤ Paquete: envoltura de 9 × (tarjeta, cuerda del cáñamo del metro, puntos y etiquetas engomadas de la flor), cada uno es diferente.
- ❤ Extremidades de la flor: color de rosa, girasol, claveles rojos, margaritas rosadas, claveles púrpuras, margaritas anaranjadas, margaritas azules, claveles verdes, callalilies blancos.
- ❤ Espacio en el interior para su mensaje personal, no proporcionamos la impresión, usted puede imprimir su propio texto, diseño o foto en la hoja interior por se. Compatible con la mayoría de las impresoras láser y de inyección de tinta.

Imágenes de Sobre originales
Aquí tienes una agrupación de fotografías de sobre originales para que te formes una idea y puedas elegir entre todos los tipos de colonia. Pincha con el ratón en una de las fotografías para ver la ficha completa del artículo y su coste.