Scirocco interior
Es oficialmente esa época del año para mudar tu fragancia y probar un nuevo y excitante perfume que va a ser totalmente bienvenido en la época. No hay nada que nos guste más que refrescar nuestros aromas en esta estación del año, probando nuevos productos como scirocco interior, l scirocco o bien scirocco. Las personas somos criaturas de hábitos: algo que puede extenderse sencillamente a su elección de olor. Pero como todas las cosas en la vida, en ocasiones vale la pena sacudirlo un poco. Después de todo, los olores, como la ropa, entran y salen de tendencia. Así sea que busque un aroma fresco y limpio o bien uno considerablemente más picante y/o almizclado, la colonia perfecta no sólo le hará olfatear como una estrella de rock (en el buen sentido), sino asimismo atraerá a quienes le rodean. Con lo que aunque tengas un mal sabor de boca, o de nariz, de cuando eras un niño mientras que recuerdas a tu abuelo bañándose en estas cosas, las colonias de hoy van a llevar tu juego de estilo y aseo al siguiente nivel.
Listado top ventas para Scirocco interior
En esta de productos vamos a enseñarte lo mejor en scirocco interior para el confort de tu bienestar. Nos queremos comprometer a que llegarás a encontrar las mejores opciones y precios de todo lo que necesites para tu cuerpo, dándote la oportunidad de descubrir diferentes marcas y modelos.

xiuxiu FIT FOR-Scirocco R Accesorios 2009-2016 Interior de Fibra de Carbono Tablero de decoración del Tablero de Instrumentos (Color Name : Left)
- Especificación:
- Mueble:
- Para-scirocco R RHD 2009-2016 / Para-scirocco R LHD 2009-2016
- Color: Como se muestra (color de fibra de carbono)
- Material: fibra de carbono.


MEIYING PINGPANG 2pcs Coche Interior De Pie DIRIGIÓ Lights Fit For Skoda Rapid Superb Seat Alhambra Ateca Golf 5 6 Jetta Passat Touareg Tiguan Scirocco (Emitting Color : Blue)
- Luz de pie de luz bajo puerta
- Luz de tronco de luz de equipaje
- Fácil instalación, reemplazo directo con OEM calidad y ajuste; Plug and Play, tiempo de inicio instantáneo rápido
- Cambie su bulbo amarillo a esta bombilla de luz de alta potencia de Xenon White Bright; para que coincida con la última mirada europea
- Especialmente diseñado para no con un código de errores de advertencia, mensaje de advertencia de bombilla; No se necesita reprogramación informática.


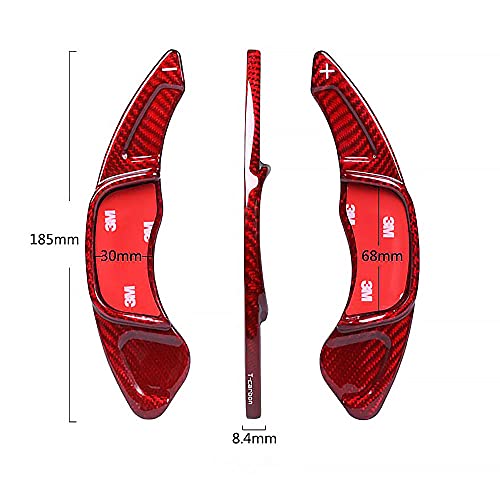
Pangyan990 2 piezas Shifter Fit Paddle Shift Car Volante de Aluminio Shift Paddle para Volkswagen VW Golf 7 2015- GTI R MK7 Scirocco Car Styling Helpful Adorable Regular
- Material de aleación de aluminio pulido superficial oxidación anódica, exquisito aluminio magenesio mecanizado CNC, agradable a la vista y fresco al tacto.
- Fácil instalación con cinta adhesiva de doble cara (las cintas están conectadas).
- La actualización mejora instantáneamente el efecto visual extremo. Ajuste exacto para la palanca de cambios original.
- Los símbolos +/- están grabados en la parte superior de cada hoja, montados exactamente para la palanca de cambios original.
- Palanca de cambios de aluminio para VW Golf 7 2015- GTI R MK7.


Verakee TYUZH-levas Volante 1 par Extend Gear Shifter Paddle Extensión, reemplazo for Golf GTI R GTD GTE MK7 7 Scirocco 2014-2019, Autopartes (Color : Silver)
- Actualizar al instante mejorar el efecto visual extrema.
- Exactamente equipado para la palanca de cambios de paleta originales.
- La +/- están grabados fuera de la parte superior de cada hoja.
- Montaje rápido y fácil: las paletas de cambio son fáciles de instalar y usar.
- Le brinda un interior elegante para el automóvil: el volante cambiado mejora el aspecto de la moldura de su vehículo para una apariencia personalizada verdaderamente llamativa.


sourcing map Tubo Silenciador Cola de Escape para Golf 6 7 Mk7 Scirocco Sagitar 1,4T
- Nombre del producto: la punta del tubo de escape ; Material: Acero Inoxidable
- Contenido del paquete: 1 x Tubo de escape Punta ; dimensión: 133 x 70mm/ 5.2" x 2.8" (Largo * Dia.)
- La forma de la punta del tubo: Recta ; Color: tono plateado
- diámetro interior de entrada: 66mm/2.6" de diámetro interior de salida ;: 60mm/0,24"
- Apto para VW Golf 6 7 MK7 Scirocco Sagitar 1.4T


H-Customs Levas En Volante levas de cambio Shift Paddle Golf 7 solo GTI R GTD Polo Gti 18 aluminio anodizado
- Adecuado para: polo Gti 18 Golf 7 (MK7), solo: GTI desde el año 03.2013 incluye FL, GTD desde el año 03.2013 incluye FL, R desde el año 11/2013 incluye FL, R-Line con volante deportivo desde el año 11 / 2013 incl. FL - Estiramiento facial Scirocco del año 04/2014 incluido FL
- Hecho de aluminio anodizado en plata
- Extensiones de las paletas de cambios originales
- Actualización óptica del interior del vehículo y mejor manejo
- instalación rápida y sencilla sin herramientas gracias a la cinta adhesiva adhesiva de doble cara 3M y tornillos prisioneros


Volkswagen Scirocco - Alfombrillas Originales de Tela
- Color: negro
- Alfombrillas delanteras y traseras.
- Tipo de montaje: sistema de botón de presión.


(Rojo) Pinalloy Extensiones de cambio de paletas DSG de fibra de carbono para Golf MK7 Scirocco GTi R
- Vehículos compatibles: Golf MK7;Scirocco / Scirocco R (2015-2016)
- Material: fibra de carbono de alta calidad; CORTE DE UNA PIEZA terminado (sin ningún tornillo)
- Incluye: extensión de paleta fabricada con fibra de carbono Pinalloy x 1 juego (izquierda y derecha); Juego de cintas 3M x 1
- Marca: Pinalloy
- Nota: Solo se puede usar para volante DSG + / - vehículo de función


Extensiones de cambio de paletas DSG de fibra de carbono para Golf MK7 Scirocco GTi R
- Vehículos compatibles: Golf MK7; Scirocco / Scirocco R (2015-2016)
- Material: fibra de carbono de alta calidad; CORTE DE UNA PIEZA terminado (sin ningún tornillo)
- Incluye: extensión de paleta fabricada con fibra de carbono Pinalloy x 1 juego (izquierda y derecha); Juego de cintas 3M x 1
- Marca: Pinalloy
- Nota: Solo se puede usar para volante DSG + / - vehículo de función


L&P A256-5 - Funda para palanca de cambios color negro costuras rojas pomo de cambios de 6 marchas compatible con Volkswagen Golf 5 V 6 VI marco Plug Play pieza recambio 1K0711113 5K0711113 1K871113
- Para los modelos de vehículos adecuados consulte la descripción o el buscador de piezas de Amazon.
- Contenido del envío: funda para palanca de cambios, pomo para palanca de cambios, marco (premontado) y abrazadera de fijación.
- Color: negro con costuras rojas. Número de marchas: 6 marchas.
- Montaje sencillo Plug & Play (se tarda aprox. 3 min).
- Apto para VW Golf 5 V año de fabricación 2003 – 2008 – Volkswagen Golf 6 VI 2008 – 2013 – Volkswagen EOS 2006 – 2014 – Volkswagen Scirocco 3 2008 – 2014 – Volkswagen Jetta 5 V + 6 VI 2005 – 2014.


Ramair Filters CC-296-UNI Filtro de Aire para Cuello Universal con Anillos reductores
- Filtro de aire de espuma de rendimiento
- Viene con anillos reductores para caber dentro del cuello del filtro.
- Anillos reductores de 70 mm, 76 mm, 80 mm, 85 mm y 90 mm.
- Jaula interna de acero inoxidable T304


ALOPEE - 4-Pack T10 194 168 921 W5W 2825 5ªGeneración 240lums LED Rojo Luz 12V-24V, 18SMD 3014 Coche Iluminación interior por Luces de matrícula Tercera luz de freno Luz Del Mapa
- (Conjunto de 4 bombillas) - Chipset de alto brillo 18SMD 3014 Rojo por bombilla, Voltaje de trabajo: 12V -24V (vehículos de 24V con carro), Tamaño: 1.04 "x 0.43"
- Valor de lúmenes: 240 Lúmenes (alrededor de 14 lums / 3014 chipset), como iluminación interior o luz trasera, brillará muy bien. Duplica la cantidad de salida de luz en comparación con la bombilla halógena, pero solo requiere 1/3 del consumo de energía con 1,7 vatios
- Comparable con la bombilla halógena de tamaño OEM y se adapta directamente a múltiples tomas de tamaño de bombilla como: 168 175 194 2825 W5W T10 T10, 147, 152, 158, 159, 161, 168, 175, 184, 192, 193, 194 2825 W5W Size, Instalación fácil, Plug and play para la mayoría de los vehículos. (Algunos vehículos más nuevos, como Mercedes Benz, pueden mostrar un mensaje de error)
- Este tamaño de bombilla puede adaptarse a muchas posiciones diferentes: luz de mapa, o luz de techo, o luz de matrícula, o luz de maletero, o luz de cortesía, etc. (dependiendo del modelo de su automóvil, algunas caben en más de 1 posición).
- ¡Compra con confianza! Ofrecemos garantía de "UN AÑO" en los artículos dañados durante el parto o que tengan un defecto confirmado del fabricante. Cualquier pregunta, contáctenos rápidamente


Safego 4 x 36mm LED Feston 1.5" C5W LED Blanca 5630 SMD 6411 6418 6 LED Luz Interior de Coche Festón Lámpara Blanco c5w luz de la placa del adorno de la boveda del bulbo de 12V Auto-Dome Bombilla
- Tamaño: 1.5 pulgadas (36 mm) de largo, Se adapta a 1.50 "36mm 6411 6418 C5W . Potencia: Alrededor de 1W-2W Cada bombilla contiene disipador de calor para evitar el sobrecalentamiento
- Voltaje: CC 12V. Emisor del alto rendimiento 5630 (5730) LED de 6pcs en cada bulbo, 180-200 lm brillante estupendo
- Algunos coches de marca alemanes (tal como Audi A3) no compatible con este item.you pueden encontrar el parpadeo o el mensaje de error en tablero de instrumentos, causa allí tienen tan muchos coches de los modelos, no podemos probar cada modelo al estado si es compatible o no.
- Utilice para luces de matrícula (lámparas de matrícula), luces de carril de interior de coche, luces de bóveda, luz de techo, mapa de luz interior, luces de espejo de vanidad o luces de área de carga, luz del tronco

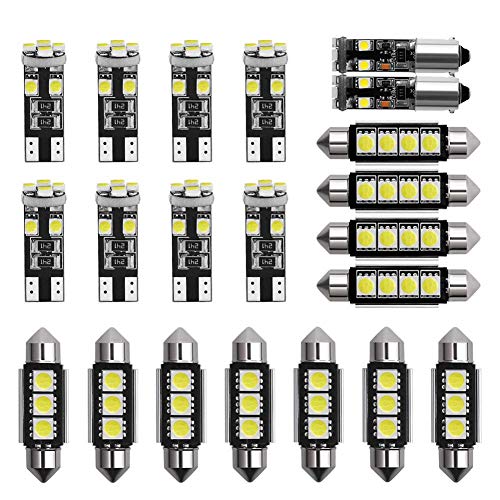
Teabelle 21 Piezas de Luz Interior LED para Coche Kit de Lámpara de Cúpula Placa de Matrícula Bombillas
- Reemplazo del kit de luz interior LED.
- Total de 21 piezas de bombillas de xenón blancas surtidas.
- Reemplace su inventario interior, domo, mapa, puerta, guantera y amp; Luz de la placa de matrícula.
- Plug and play directo, sin modificaciones.
- Temperatura de color: 6000K ~ 8000K


Escobilla limpiaparabrisas Bosch Aerotwin AM462S, Longitud: 600mm/475mm – 1 juego para el parabrisas (frontal)
- Volumen de suministro: 1 juego para el parabrisas (frontal), el lado del conductor (longitud: 600mm) y el lado del acompañante (longitud: 475mm)
- Excelente rendimiento de limpieza en cualquier clima
- Mayor vida útil gracias a la tecnología Power Protection Plus
- Funcionamiento silencioso tanto en parabrisas húmedos como semisecos
- Diseño aerodinámico: Evita el levantamiento y las vibraciones gracias a la reducción del viento para mejorar el confort del conductor y la velocidad.
- Instalación rápida y sencilla gracias al adaptador premontado


YOTINO Moldura Interior del Coche Tiras Líneas de Molduras Hay una Herramienta de Instalación Práctica y Flexible para Decoración Interior Coches, Tiras de Ajuste de Universal (10m Rojo)
- Materiales de alta calidad: la línea de decoración de automóviles está hecha de plástico PVC suave, inodoro e inocuo para el medio ambiente, de apariencia hermosa, resistente al desgaste, resistente al calor y anticorrosión. Excelente rendimiento práctico, interior del coche perfecto.
- Función única: línea interior de automóvil decorativa, sin necesidad de conectar la electricidad, fácil de instalar, instalación sin pegamento, desmontaje sin rastro, la línea de decoración del automóvil tiene una gran flexibilidad, fácil de usar.
- Ningún daño para el automóvil: la línea de corte de rayas está instalada en su automóvil. No daña la superficie del automóvil y se puede instalar fácilmente en esquinas estrechas y lugares difíciles de alcanzar para que su automóvil destaque.
- Ahorre tiempo y esfuerzo: tiras de ajuste coche incluye una herramienta de instalación que le ayuda a instalar la línea de corte sin carga. Es más fácil que instalar las correas a mano solamente.
- Amplia aplicación:Muy practico es adecuada para la decoración de la parrilla de entrada, decoración de la lámpara de cola, faros, ventana, artículo de decoración de la cubierta de la rueda ect.

Imágenes de Scirocco interior
Si quieres elegir de forma visual los artículos, puedes observar aquí una serie de imágenes de scirocco interior. Pincha en una de las fotografías y entrarás a la obtención online de colonia en concreto viendo sus peculiaridades y valor.