Vision night
Hallar el perfume perfecto no tiene por qué ser un desafío. Si estás buscando un nuevo perfume de autor, sabemos de qué manera asistirte a reducir la selección. Así que así sea que estés comprando para ti o bien para alguien singular en tu vida, hallarás a continuación buenos productos y perfumes como vision night, vision sport o vision of love, que están aprobados por especialistas para mujeres y hombres. Si eres una persona que no actualiza su fragancia tan de forma frecuente como debería (no te estamos juzgando) puede que te resulte interesante saber que si guardas tu colonia en el baño, donde está expuesta al calor, al vapor y a la humedad (gracias por nada, en la ducha), rompe absolutamente las notas y dejándola, bueno, generalmente mohosa. No tengas miedo de tomar ciertos peligros y mudar tu fragancia favorita en ocasiones. Mas, ¿qué significa todo esto realmente? Aprende a elegir la colonia conveniente para ti acá.
Listado top ventas para Vision night
Gracias a esta de referencias queremos mostrarte lo mejor en vision night para el bienestar de tu cuerpo. Que sepas que para poder encontrar multitud de opciones para poder comprar lo mejor para tu bienestar, te encuentras en uno de los mejores sitios web de la red.

1080P HD Hot Link Remote Surveillance Camera Recorder, 150 ° Wide Angle Mini Spy Hidden Camera with Night Vision and Motion Detection For Home/Office/Garage
- 【1080P Full HD Mini Camera】Support 1080P/720P HD resolution. The miniature camcorder records video at an excellent 1920X1080P HD at 30 frames per second. With video, picture, loop recording, motion detection, infrared night vision, time display, magnetic and other functions. The hidden camera with a wide angle of view of 110° can monitor any place within a standard distance.
- 【Night Vision & Easy to install】 Built-in 6 hidden infrared lights for a clear display in low light condition(No-Glow in use), the light working distance reach to 5m which makes it perfect as a home security camera or a housekeeper/ nanny cam for recording both snapshot picture and videos without attracting any attention. With the internal magnet, Upgraded hidden camera can be adsorbed on any iron surfaces easily.
- 【Built-in 250mah Battery】As A mini WIFI Camera, It built-in 250mah battery, fully charged, can work about 40-60 minutes, Also you can get the camera plugged into a USB charger (or power bank) for recording 24/7 hours. With Wifi connectivity to room's 2.4GHz router, you can watch live video feed or playbacks no matter where you are by accessing the APP.
- 【Waterproof】Night vision function equipped with high intensity infrared LED lights, supports night vision recording. Double filter light switch that automatically changes color to black at night, protecting your day and time. With diecast aluminum shell, powder coating technology, wear and scratch resistance, waterproof, very suitable for outdoor use.
- 【Remote Sensing】 Remote display via APP. You can see what's happening from anywhere. Wireless camera for any surveillance, perfect for surveillance cameras / baby monitors / nanny cameras / dogs / pet cameras.When a moving object is detected, it automatically records a video and sends a warning message to your phone. You will be the first to know. Protect your family and loved ones simply and effectively.


SIONYX Aurora I Full-Color Digital Night Vision Camera with Hard Case I Infrared Night Vision Monocular with Ultra Low-Lig.


Bresser 1877491 Dispositivo de visión Nocturna Digital NV Binocular 3X con función de grabación monocromática, Normal, Negro
- Aumento: 3x con zoom digital 2x; alcance de hasta 130 m con imagen en blanco y negro de alto contraste
- Función de grabación para grabar los eventos; pantalla grande, cómoda visión con ambos ojos
- Duración de la batería: aprox. 5 horas / 640 x 480 / lcd 320 x 240 / iluminación infrarroja integrada con 5 niveles de brillo / zoom digital 2x
- Dimensiones: 195 x 143 x 48 mm; peso: ligero 429 g
- Contenido del envío: dispositivo de visión nocturna, correa de transporte para bolso o dispositivo, funda
- Nombre de departamento: Unisex adulto


EZVIZ WiFi Cámara de Vigilancia 1080p Visión Nocturna Colorida, IP Cámara de Seguridad FHD Defensa Activa,Luz Estroboscópica&Sirena,IP67,Audio Bidireccional,Compatible con Alexa,C3W Color Night Vision
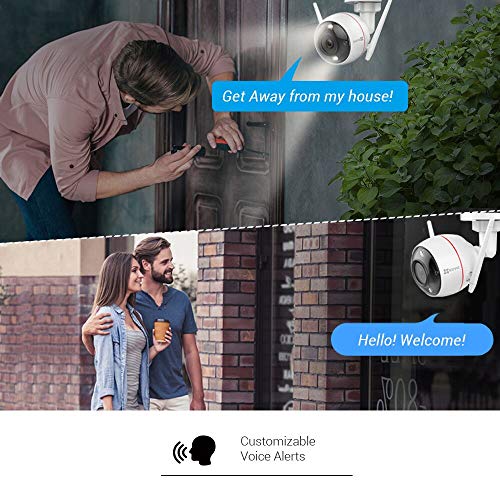
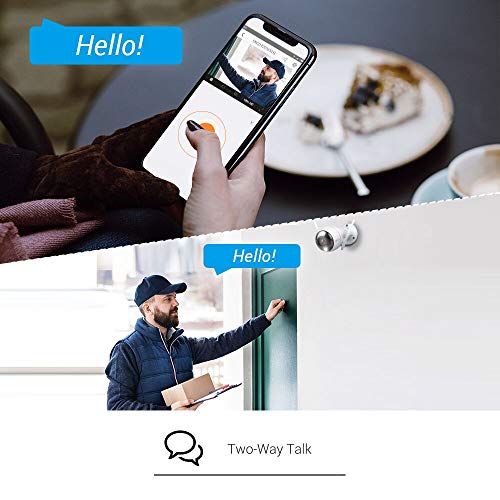
- Audio bidireccional; puede comunicarse con su familia o sus mascotas o asustar a los intrusos gracias al micrófono y al altavoz integrados
- Su visión nocturna ahora está iluminada y vívidamente restaurada a todo color gracias a un eficiente sistema de visión nocturna compuesto por dos focos y dos luces infrarrojas
- Alarma con sirena y luz estroboscópica; una vez que se detecta un movimiento, activa una sirena y emite una luz estroboscópica; puede decidir habilitar y deshabilitar el sistema de alarma manualmente
- Alertas personalizadas; junto con los sonidos de alerta predeterminados, la cámara también te permite grabar tres mensajes de audio de 10 segundos para dar la bienvenida o disuadir a los visitantes
- Ip67 clasificado; esto significa que es resistente al polvo y al agua, puede instalarlo donde lo necesite
- Aviso de movimiento instantáneo; cuando la cámara detecte movimientos o intrusos, recibirá alertas de inmediato, solo verifique y asegúrese de que todo vaya bien en su hogar cuando y donde sea
- La cámara cuenta con la compresión de video H.265 de tecnología, logrando una óptima calidad de video con solo la mitad de ancho de banda y la mitad del espacio de almacenamiento que la H.264 estándar de compresión de video


4K Videocámara UHD 48MP WiFi IR Night Vision Vlogging Cámara para YouTube Pantalla Táctil Grabadora de Cámara con Zoom Digital 16X con Micrófono, Estabilizador, Parasol para lente, Control, 2 baterías
- Cámara de video 4K Ultra HD con estabilizador de mano: sensor de imagen CMOS de 13 megapíxeles, resolución de imagen de 48.0 MP (7920 * 5940), pantalla táctil de 3.0 pulgadas con rotación de 270 grados, zoom digital de 16X, grabación mientras se carga (3.7V 2000mAh 2 baterías recargables) ect .Soporte estabilizador de mano plegable Mantiene estable la cámara 4K durante la grabación, ideal para hacer videos e imágenes de ángulo bajo en movimiento, y ayuda a extender la distancia de filmación.
- Videocámara 4K Wifi y visión nocturna por infrarrojos: descargando la aplicación "RoadCam", fácil de conectar la videocámara con teléfonos inteligentes y tabletas. Luego, puede buscar imágenes, transferir, compartir películas y fotos a través de sus dispositivos móviles o controlar la cámara a distancia mediante la aplicación. Simplemente presione el botón '' OK '', esta cámara de video de Youtube con luz LED infrarroja le permite tomar fotos o videos claros en blanco / negro en la oscuridad.
- Cámara con parasol & Control remoto inalámbrico de 2.4G: la cámara de video de Youtube viene con un parasol. Puede bloquear el exceso de luz y proteger la lente de la videocámara de daños accidentales. Mejora el color y el contraste en general de las fotos. Para trabajar con parasol, esta cámara de youtube está equipada con control remoto inalámbrico 2.4G, que puede controlar la cámara digital a 60 pies desde cualquier dirección.
- Función de cámara web y micrófono externo: la cámara de video digital admite video chat y transmisión en vivo cuando se usa como cámara web. Simplemente conéctelo a la PC mediante un cable USB, elija el modo 'Cámara USB' para ingresar a la función de cámara web. También puede hacer video chat con amigos o familiares. de -10dB a + 20dB para mejorar la estabilidad y recibir un audio claro.
- Videocámara multifuncional: la videocámara admite anti-vibración, función de pausa, lapso de tiempo, cámara lenta, disparo continuo, captura de rostros, temporizador automático, función de belleza, estabilización de imagen, apagado automático, salida de TV HDMI, MSDC, Mini USB2. 0, con zapata y conector de micrófono externo, admite luz LED externa y trípode (trípode y luz no incluidos) .Con dos baterías. Una batería completamente cargada se puede usar de manera sostenible durante 90-150 minutos.

Night Vision Gafas de conducción nocturna
- 100% marcos de metal 100% lentes de vidrio
- Incluye una bolsa protectora.


Binoculares de visión Nocturna Alcance de Caza infrarrojo Digital HD, Imagen 1080Py Video 720Py cámara IR de Pantalla LCD de 2.31"en 400m para Vida Salvaje (Incluye una Tarjeta TF de 32GB)
- PANTALLA ANCHA TE TRAE VISTA COMPLETA: Binoculares de visión nocturna con pantalla ancha TFT LCD incorporada de 2.31 ", convertida a pantalla grande de 3 pulgadas por la lente convexa. Combina un sistema totalmente óptico totalmente recubierto con una cámara de video, puede graba imágenes HD de 1280 * 960 y videos 960P con detalles vívidos.Pantalla LCD muy fácil de ver, controla rápidamente diferentes funciones para capturar imágenes o videos en alta definición
- HAGA SU VISIÓN MÁS CLARA / MÁS CLARA: Las gafas de visión nocturna con LED infrarrojo de 3W incorporado, el iluminador de 850nm permiten observar el objetivo en condiciones completamente oscuras y el alcance de hasta 984 pies / 300m. Se puede usar como telescopio con IR apagado para el color durante el día. En la oscuridad, cuanto más alto se ajusta el nivel de luz infrarroja, más lejos y más clara es la observación, 7 niveles de IR son ajustables de acuerdo con la luz ambiental.
- LA NOCHE NO PUEDE DETENER SU AVENTURA: una excelente claridad óptica, los prismáticos de visión nocturna digital de alto rendimiento con sensor CMOS logran una visión clara de hasta 3 aumentos. El zoom digital 4X permite al usuario acercar un objeto o alejarlo a una perspectiva más amplia. La apertura objetiva de 25 mm y el ángulo de visión de 10 ° le ofrecen más campo completo.
- DON'T WORRY ABOUT POWER: Up to 6 hours of continuous video recording time, as well as 17 hours of constant operation without infrared lights in the daytime, with 6 AA batteries (not included) powered. Great for night hunting, reconnaissance, security and surveillance, camping, night navigation, night fishing, wildlife observation, search and rescue, bird watching, landscape photos 383/5000 NO SE PREOCUPE POR LA ENERGÍA: hasta 6 horas de tiempo continuo de grabación de video, así como 17 horas d
- FUERZA DE MARCA CON 100% DE SATISFACCIÓN O DEVOLUCIÓN DE DINERO: Capacidad de almacenamiento: 4GB a 32GB (¡INCLUYEMOS 32GB COMO BONIFICACIÓN en el paquete ya!). No se preocupe por la falta de espacio de almacenamiento intermedio. Función de reproducción, fácil de ver en gafas nocturnas directamente; IP56 Resistencia al agua. Si no está satisfecho con nuestras gafas de visión nocturna, respaldamos nuestros productos y le garantizamos un reembolso del 100%.


Gearmax® Gafas de Visión Nocturna con Azul Flip-Fuera Llevaron Luces
- Nuevo y de alta calidad,Proteger los ojos de los ninos cuando estan jugando balas de pistola de juguete , fuegos artificiales ect.
- Gafas de vision nocturna con luces flip out,Lente verde tenido con graficos grabados que se iluminan cuando las luces estan encendidas.
- Almohadilla para la nariz suave, Pop out luces que haz una luz azul fresco en la oscuridad.
- Ver en la oscuridad 25 pies,Bandas elasticas ajustables para un ajuste comodo.
- Diseno ergonomico , vision amplia y de seguridad para el desgaste,Las luces LED no necesitan ser reemplazados.


Night Vision Classic
- Simulate a night vision effect!
- Take night vision pictures!
- Go commando with Night Vision


Bushnell - Equinox Z - 4.5x40 - Negro - Digital Night Vision - 260140
- El sistema de visión nocturna digital Equinox Z de Bushnell ofrece una claridad óptica extraordinaria, una iluminación máxima y un campo de visión inigualable.
- Funciones como la captura de imágenes, la grabación de vídeo y el color diurno con nuestra tecnología digital NV supercargada.
- Otras características que marcan la pauta son la larga duración de la batería, la capacidad de montaje en trípode y los objetivos de cristal.
- Brillo IR ajustable
- Objetivo de cristal Captura de imágenes. Recogida probada hasta 35 g.


Bresser Binoculares Digitales de Visión Nocturna 3X20
- Ampliación: 3X (6 aumentos con zoom digital)
- Alcance la iluminación infrarroja: 100 m
- Dimensiones: 185 x 145 x 55 cm / peso: 680 g
- Pantalla grande, visión cómoda

IMX219-160IR Camera for NVIDIA Jetson Nano Developer Kit 8-megapixel Infrared Night Vision IR Camera Module with IMX219 Sensor 160 Degree FOV
- IMX219 Infrared Night Vision Camera for NVIDIA Jetson Nano Developer Kit
- Supports night vision when works with infrared LEDs
- 8 Megapixels
- Sensor: Sony IMX219
- Resolution: 3280 × 2464


Philips 12972RVS2 RacingVision- Juego de Bombillas H7, 2 Unidades
- Tecnología: Halógena
- Tipo: H7
- Aplicación: Luz de largo alcance; Luz de corto alcance
- Denominación: RacingVision H7
- Base: PX26d
- Lúmenes: 1500 lm


OSRAM NIGHT BREAKER UNLIMITED H11, Halogen-Scheinwerferlampe, 64211NBU-HCB, automóvil de 12 V, caja doble (2 unidades)
- NIGHT BREAKER UNLIMITED de OSRAM: Luz óptima para tener más tiempo de reacción, de modo que los conductores puedan identificar claramente los obstáculos y los peligros antes.
- Hasta un 110 % más de luz (en comparación con las lámparas estándar) en la carretera con el recubrimiento de anillo azul patentado, que ofrece una luz libre de deslumbramiento.
- Un cono de luz con hasta 40 metros más de largo (en comparación con las lámparas halógenas estándar, según el tipo): obtenga una mayor visibilidad y tiempos de respuesta significativamente mejores.
- Con luz hasta un 20 % más blanca (en comparación con las lámparas halógenas estándar): obtenga una conducción sin fatigas y relajada.
- Desarrollada específicamente para el conductor preocupado por el rendimiento y con certificación ECE.


Longruner for Raspberry Pi 4 Camera Module 5MP 1080p OV5647 Sensor HD Video Webcam Night Vision for Raspberry Pi 4 3 model B B+ A+ RPi 2 1 LSC15
- Supports Raspberry Pi model B/B+ A+ RPi 3 2 1
- 5 megapixel OV5647 sensor ,Supports up to 2 infrared LED and/or fill flash
- Night Vision Camera for all version of RPI
- Package Contains: 2*Infrared LED Light, 1*Infrared Night Vision Webcam Camera Board
- 2592 x 1944 pixel static images; Capture video at 1080p @ 30 fps, 720p @ 60 fps and 640x480p 60/90


Mini Spy Camera Wireless Hidden Home WiFi Security Cameras with App 1080P, Inc 32GB SD Card + Plus More. Visión Nocturna Movimiento Activado Interior Exterior iPhone/Android Teléfono Pequeña
- TOP NIGHT VISION SPY CAMERA FabQuality wifi spy camera es con 8 LEDs infrarrojos ocultos sin iluminación alrededor de la lente que son invisibles y encubiertos con un rango visual nocturno de hasta 16 pies (la visión nocturna debe ser activada a través de la aplicación). Es una cámara de seguridad portátil ideal para el hogar y el automóvil.
- FÁCIL DE OCULTAR CÁMARA PEQUEÑA MINI SPY: Esta cámara espía tiene un diseño redondo que es pequeño y robusto. Con una correa de muñeca para llevar, es fácil de llevar. Usted puede poner esta cámara espía en la esquina de la casa, oficina, tienda, coche, incluso en el bolsillo o en su mochila con un imán fuerte que se puede adsorber en cualquier superficie de metal. Además, también puede ser utilizado como una cámara de seguridad, cámara de vigilancia, cámara de video de coche, cámara de acción
- DETECCIÓN DE MOVIMIENTOS Y VISIÓN NOCHE Con la detección de movimiento inteligente mejorada, ahora puede ajustar la sensibilidad del sensor manualmente. Una vez que se detecta un movimiento, la cámara oculta enviará una Notificación Push con imágenes a su teléfono. Puede iniciar sesión en la aplicación para ver lo que está sucediendo en tiempo real y no preocuparse de perderse algo importante. El dispositivo cuenta con un diseño encubierto de 6 luces infrarrojas IR con no luminancia y 5M de di
- VÍDEO HD 1080P Y ÁNGULO DE VISUALIZACIÓN DE 150°: Esta cámara oculta utiliza un avanzado sensor de imagen de 2,0 MP que capturará vídeo HD 1920 x 1080P a 25 fps con una reproducción precisa del color. El vídeo en directo se puede ver a través de iOS/Android Smartphone, Tablet, Mac o Windows PC. Y esta cámara oculta wifi tiene un objetivo gran angular de grado profesional de 150°, creando una gran cobertura para monitorear su cuidado, perfecto para su casa, oficina o familia como ama de llaves,
- INCLUYE - Tarjeta SD de 32GB + Lector USB + Adaptador de Tarjeta Con su propio conector USB incorporado de tamaño completo o puede utilizar el cable USB para cargar la cámara de la pluma a través del PC. Esto significa que no tiene que acordarse de llevar consigo piezas adicionales. Conéctalo al puerto USB de tu televisor inteligente para ver fotos y vídeos al instante. Hágalo en su próxima reunión familiar y vea la expresión de asombro en la cara de todos cuando se ven a sí mismos en la telev


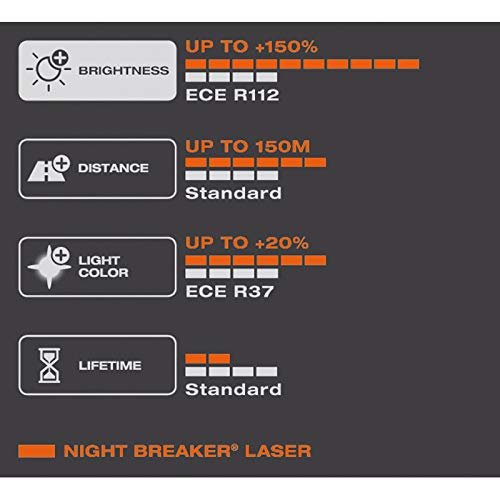
OSRAM NIGHT BREAKER LASER H4, Gen 2, +150% más luz, bombillas H4 para faros delanteros, 64193NL-HCB, 12V, duo box (2 lámparas)
- Hasta un 150% más de luz para su vehículo gracias a la innovadora tecnología de ablación láser.
- Haz de hasta 150 m de largo para una mejor visibilidad y un 20% de luz más blanca que proporciona un aspecto moderno.
- Vea más lejos y reaccione más rápido mientras conduce con esta potente lámpara halógena.
- Calidad premium fabricada en Alemania / EE.UU: Disponible en H1, H3, H4, H7, H8, H11, HB3, HB4.

Imágenes de Vision night
Si quieres elegir de forma visual los productos, aquí puedes ver un montón de fotos de vision night. Haz click en una de las fotografías y entrarás a la obtención online de perfume en concreto viendo sus propiedades y valor.