Mirada felina hombre
Un perfume característico, bajo cualquier circunstancia y a cualquier edad, debe ser intemporal y llevable. Mas, por supuesto, escoger el perfume adecuado para puede ser un desafío con tantas fragancias en el mercado. Por este motivo aquí te dejamos las mejores como mirada felina hombre, wow forma felina o l occitane mirada divina. ¿Pero de qué manera sabes en qué momento has encontrado la mejor colonia para ti? Reconocerás tu aroma característico cuando lo huelas. Es un poco como el amor: Escoge la que atraiga más cumplidos. Tú, y la gente que te circunda, deberían disfrutar del aroma. A continuación se presentan ciertas opciones mejores de colonia para hombres y mujeres, escogidas por los expertos en estilo y aseo de mrperfume.es. Todos estos productos vienen de diseñadores que saben todo sobre la elaboración de un perfil de olor atrayente.
Listado top ventas para Mirada felina hombre
Descubre nuestro listado de productos dónde podrás encontrar mirada felina hombre que tengan las necesidades de tu bienestar. Nos queremos comprometer a que llegarás a encontrar las mejores alternativas y precios de la totalidad de lo que busques para , ofreciéndote la opción de descubrir diferentes modelos y marcas.

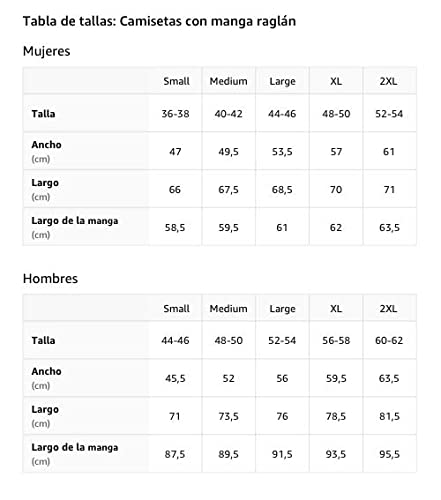
Lindo gato mirando a través del agujero Feline Kitty Pet Cub Camiseta Manga Raglan
- Este bonito gato está buscando. Ayúdalo a pasar a través del agujero y usa esta ropa de gatito. Gran idea de regalo para los amantes de los gatos, padres de bienestar animal y rescate de animales o activistas de derechos.
- Esta ropa de diseño felino es perfecta para los propietarios de mascotas o para apoyar el Día Mundial de los Animales
- Ligero, Encaje clasico, manga de doble puntada y bastilla baja


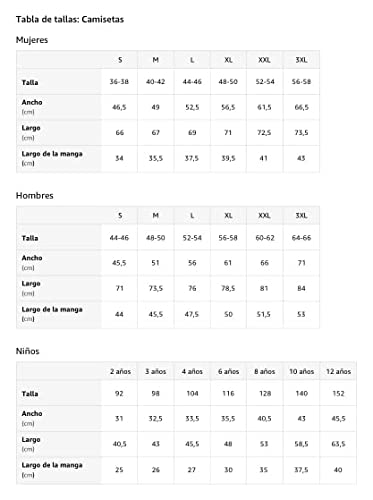
Lindo gato mirando a través del agujero Feline Kitty Pet Cub Camiseta
- Este bonito gato está buscando. Ayúdalo a pasar a través del agujero y usa esta ropa de gatito. Gran idea de regalo para los amantes de los gatos, padres de bienestar animal y rescate de animales o activistas de derechos.
- Esta ropa de diseño felino es perfecta para los propietarios de mascotas o para apoyar el Día Mundial de los Animales
- Ligero, Encaje clasico, Manga de doble puntada y bastilla baja


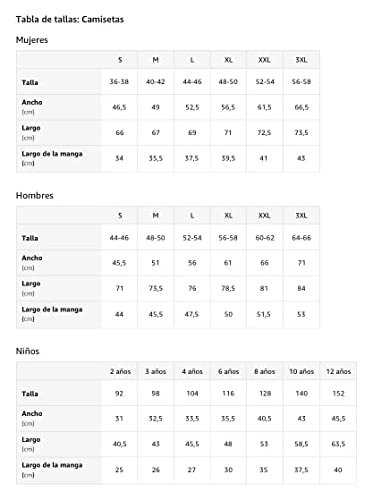
Mirando bien felino mejor fresco retro gato amantes gatito mascota Camiseta
- Se ve bien felino mejor guay retro amantes de los gatos gatitos mascota
- Se ve bien felino mejor guay retro amantes de los gatos gatitos mascota
- Ligero, Encaje clasico, Manga de doble puntada y bastilla baja


Planificador diaro 2022: La mirada de la pantera de florida. Agenda de un año. Formato largo. Una página por día, horarios de 6 am / 11 pm, lista de tareas pendientes, notas. Calendario.


PUMA ESS Logo Pants TR op SRL Pants, Hombre, Puma Black, XL
- Estampado en pigmento en relieve del logotipo Nº 1
- Logotipo del felino estampado con pigmentos
- Corte recto
- Cintura elástica con cordón en el interior


PUMA Ftblnxt Pro tee Camiseta de Manga Corta, Hombre, Amarillo (Ultra Yellow Black), L
- Corte entallado
- Cuello en color de contraste
- Estampado por sublimación en la parte delantera
- Logotipo del PUMA por transferencia de calor en la parte derecha del pecho
- Gráfico cortado a láser en el centro de la espalda


Puma Power BND M TR tee Camiseta de Manga Corta, Hombre, Blanco White
- Cuello redondo
- Manga corta
- Marca PUMA escrita invertida en la espalda
- Logotipo del felino PUMA en la parte izquierda del pecho
- Poliéster y elastano


Head Case Designs Licenciado Oficialmente Riza Peker Mirada Felina Abstracto Animal Carcasa de Cuero Tipo Libro Compatible con Kindle Paperwhite 1/2 / 3
- Producto Head Case Designs Licenciado Oficialmente Riza Peker
- Diseño en cuero elaborado a mano
- Varios bolsillos para el DNI y las tarjetas de crédito
- Soporte multiusos. Perfecto para ver películas
- Sistema de cierre magnético


Head Case Designs Licenciado Oficialmente Riza Peker Mirada Felina Abstracto Animal Carcasa de Cuero Tipo Libro Compatible con Find X3 Neo / Reno5 Pro+ 5G
- Producto Head Case Designs Licenciado Oficialmente Riza Peker
- Diseño en cuero elaborado a mano
- Varios bolsillos para el DNI y las tarjetas de crédito
- Soporte multiusos. Perfecto para ver películas
- Sistema de cierre magnético


Esclavo Heredero (Manada de Guerreros nº 1)


MENGKE Collar de Leopardo Hip Hop joyería exagerada Dominante Felina Colgante Hombres,Plata
- Este producto se refina usando circón AAA y ambientalmente amigable collar materials.This chapado en cobre es de 20 pulgadas de largo y alrededor de 8 mm de ancho.
- El proceso utiliza circón micro-incrustaciones con el chapado en oro de 18 quilates / platino. El estilo combina la moda y da nueva vida. Citas, trabajo, ocio, viajes, maravillosas ocasiones diferentes son siempre el foco de atención ..
- El aspecto único añadirá un toque impresionante a su mirada! Le hace más atractivo y atractivo ....
- Para asegurarse de que está completamente satisfecho con su compra, si tiene alguna pregunta sobre este producto, puede ponerse en contacto con nosotros a través de correo electrónico y nos pondremos en contacto con usted dentro de 24 horas. Si la calidad del producto comprado es defectuoso, le ofrecemos una garantía de devolución de dinero de 30 días.


Amilril Collar, Colgante Luna y Gato, Plata de Ley 925 Moda Joyería, Regalos Navidad Originales
- ❤Especificación❤ Tamaño pendiente:15.5mm*15.6mm(0.61*0.62inch). Tamaño de cadena: 45 cm(18inch) cadena de plata súper fuerte. Peso: 3.3g(0.11oz)
- ❤Material de alta calidad❤ hecho de plata de ley 925 fina, sin alérgenos, sin níquel, sin cadmio y sin plomo, 100% seguro para el cuerpo humano durante mucho tiempo.
- ❤Bellamente embalado❤ viene con una hermosa caja de regalo, perfecta para regalar a tu amada.
- ❤Regalos ideales para las Mujeres❤ Grandes regalos para las mujeres, regalos para la mamá, regalos para la suegra, regalos para la esposa, regalos para la hija, regalos para la tía, regalos para el mejor amigo, etc. Regalos de cumpleaños ideales, regalos del aniversario, regalos de la Navidad, regalos de la graduación, regalos del día de madre, el etc.
- ❤Marca❤ Amilril Joyería Diseñado por los diseñadores franceses, se produce con la artesanía exquisita.


Feline Navidad - Feliz Navidad for Cats Camiseta sin Mangas
- Este gran diseño navideño es el regalo perfecto para el tiempo contemplativo. Ya sea solo o con la familia, con este fresco motivo navideño ya has ganado. Estoy seguro de que conseguirás una risa o una mala mirada.
- Decora el árbol de Navidad o prepara el festín, pero por favor usa el diseño correcto también. Es divertido o serio, sólo es Navidad una vez al año. Les deseo a todos una Navidad tranquila y muchos regalos bajo el árbol.
- Ligero, Encaje clasico, manga de doble puntada y bastilla baja


Feline Navidad - Feliz Navidad for Cats Sudadera
- Este gran diseño navideño es el regalo perfecto para el tiempo contemplativo. Ya sea solo o con la familia, con este fresco motivo navideño ya has ganado. Estoy seguro de que conseguirás una risa o una mala mirada.
- Decora el árbol de Navidad o prepara el festín, pero por favor usa el diseño correcto también. Es divertido o serio, sólo es Navidad una vez al año. Les deseo a todos una Navidad tranquila y muchos regalos bajo el árbol.
- 241 gr, Encaje clasico, Cinta de sarga en el cuello

Imágenes de Mirada felina hombre
Si lo que prefieres es elegir de forma visual los artículos, aquí puedes observar un montón de imágenes de mirada felina hombre. Haz click con el ratón en una de las imágenes y accederás a la obtención online de colonia en concreto viendo sus funcionalidades y valor.