Comentario critico el perfume
Un perfume será la primera cosa que procures antes de salir por la puerta, y un aroma que disfrutarás todo el día. Para ayudarte a hallar una nueva olor para añadir a tu rutina diaria, hemos encontrado las mejores fragancias, como comentario critico el perfume, primavera amarilla comentario critico o bien comentario matrix, que los críticos adoran por sus aromas universalmente agradables. Depende absolutamente de nuestros recuerdos si un fragancia nos llega o bien no a la psique, lo que explica por qué algunos de nosotros estamos emocionados por un soplo de hierba recién cortada o de gasolina, mientras que otros. No tanto. La colonia es el arma segrega de todo hombre y mujer. Un aerosol antes del trabajo, de una cita o de una fiesta no solo da un impulso instantáneo en el atrayente, sino asimismo infunde una confianza extra cuando se lleva en compañía de otros. ¿Cómo hace el caballero o la dama modernos para adquirir la mejor colonia? Empiezan por educarse en la ciencia de los aromas.
Listado top ventas para Comentario critico el perfume
Deseamos que con este listado de productos puedas encontrar comentario critico el perfume al mejor precio y mejor calidad para el cuidado y bienestar de tu salud. Encuentra numerosas referencias de diferentes marcas con buena calidad y a buen precio para todo lo que necesitas para tu bienestar.

3 x Brut – después del afeitado Parfums Prestige 100 ml por Faberge
- Pack de 3 x 100 ml
- Aroma fresco Iconic
- Refinado Spicy Woods, lavanda y ámbar fragancia
- Distintivo fragancia de París para el hombre masculina
- Brut por de música


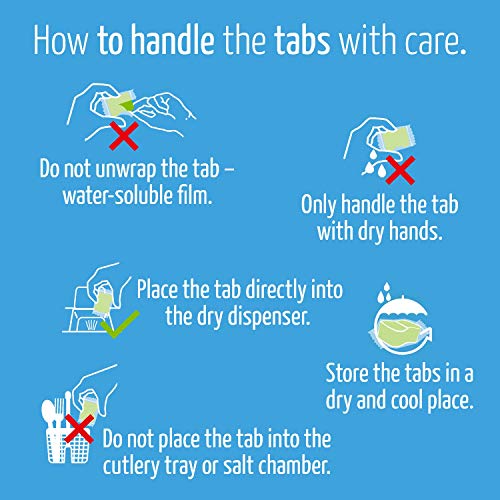
Claro Classic Pastillas Lavavajillas - 100 Capsulas - Biodegradables, sin Plastico y Fosfatos
- PAQUETE DE AHORRO DE CANTIDAD 100: En cada compra recibes 100 tabletas de lavavajillas claro Classic! Para una mejor limpieza recomendamos que este producto sea usado con el abrillantador claro y la sal alpina.
- SIN PLÁSTICOS / MICROPLÁSTICOS: Nuestras pastillas para el lavavajillas están empaquetadas en un envoltorio patentado biodegradable y soluble en agua de PVA que no debe ser retirado antes del lavado.
- HECHO EN AUSTRIA: Todos los productos de claro están hechos en Austria en el pintoresco Mondsee y con los más altos estándares: sin fosfatos, sin aceite de palma, sin cloro, vegetarianos y sin pruebas con animales.
- EXCELENCIA: nuestras pestañas para lavavajillas están garantizadas con el medio ambiente y han sido galardonadas con la etiqueta ecológica Austria y la etiqueta ecológica de la EU
- EL MUNDO DE CLARO: ¡Experimente todo lo que claro tiene para ofrecer en su línea de productos ecológicos en Amazon! Pestañas clásicas: B01EV6B9F8, Pestañas múltiples: B014170TFS, Abrillantador: B01N4TQ6JH, Sal alpina: B01N672EXE, Limpiador de lavavajillas: B01H1SHJNO

CYTOLNAT® Centella 50 ml - Crema calmante y restauradora - Hipoalergénico y no comedogénico.
- ⚡ Acción: Repara y calma la piel atacada por el medio ambiente (sol, quemaduras, frío, contaminación), por estrés mecánico (depilación, afeitado) y por agentes químicos (peeling, jabones alcalinos, detergentes).
- ✨ Uso: Adecuado para pieles sensibles para uso diario. Se utiliza en el acompañamiento de determinados tratamientos terapéuticos: láseres, radioterapia...
- ☘ Características del producto: Natural, no comedogénico, hipoalergénico y libre de parabenos.
- ✔Control: Probado bajo control dermatológico - Eficacia clínicamente probada.
- 📍 origen: Creado y fabricado en Francia.


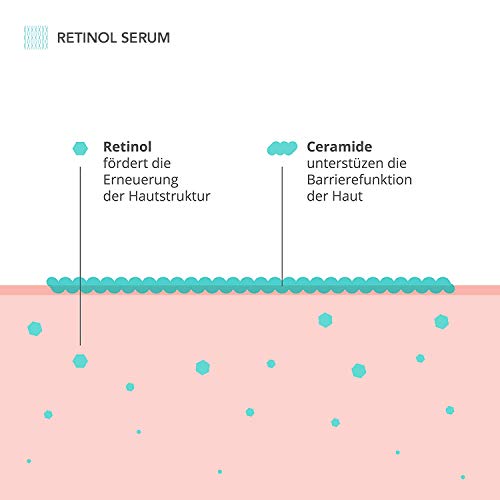
Sérum de retinol de dosis alta - Complejo activo de 4 ingredientes con retinol, retinal, bakuchiol y ceramidas - Vitamina B3 - Serum Retinol puro para la cara - Contorno de Ojos - Made in Germany
- ✅ REGENERA LAS CÉLULAS DE LA PIEL: contiene un complejo especial de ingredientes activos que aumenta la elasticidad y la hidratación de la piel. El retinol apoya el desarrollo del tejido conectivo y estimula la producción de células de la piel sanas. De esta forma, aparecen menos arrugas y la piel se vuelve más uniforme.
- ✅ SUAVIZA LAS ARRUGAS: el retinol puede mejorar visiblemente las arrugas, las ojeras y las manchas pigmentarias. El sérum aporta a la piel vitaminas y minerales importantes. Las ceramidas contenidas protegen contra la pérdida de humedad y la vitamina B3 estimula además la formación de colágeno.
- ✅ SIN ENSAYOS EN ANIMALES - VEGANO - FABRICADO EN ALEMANIA: todos nuestros productos no contienen ingredientes de origen animal y no están probados en animales. Además, no utilizamos ningún aditivo polémico: SIN silicona, SIN microplásticos, SIN parabenos, SIN perfumes, SIN aceites minerales, SIN PEGs.
- ✅ EFECTO INTENSO: el sérum se puede aplicar rápidamente y tiene una gran acción profunda. Los ingredientes de alta calidad aportan humedad a la piel y refuerzan el efecto antiarrugas.
- ✅ SATISFACCIÓN 100 % GARANTIZADA: nuestro objetivo es que estés completamente satisfecho con nuestros productos. Si no estás satisfecho, te devolveremos tu dinero en un plazo de 30 días posteriores a la compra.


Ocucan Rex Limpiador de Oídos para Perros y Gatos, Limpiador Ótico y Auricular - 100 ml
- PREVIENE LA ACUMULACIÓN DE SUCIEDAD - El uso de Ocucan Rex Limpiador Auricular está especialmente indicado en razas con orejas caídas porque evita la acumulación de suciedad, detritus y exudados en los conductos auditivos. Muy recomendable en razas predispuestas a la otitis (Coker, Labrador, Retriever, Caniche, Fox Terrier,...)
- ELIMINA EL CERUMEN - Contiene componentes eficaces y de alta tolerancia que ayudan a deshacer el exceso de cera del oído del perro.
- SUAVE CON LAS OREJAS - Limpieza segura por la biocompatibilidad de los ingredientes y la baja concentración de conservantes.
- INOCUO Y MUY EFICAZ - Solución fisiológica con pH neutro afín al de la piel del oído del perro, con lo que no provoca irritación. No contiene sustancias agresivas, como parabenos, perfume, alcohol o esencias, que pueden llegar a irritar
- PARA UNA HIGIENE CORRECTA - Es recomendable usar un limpiador de oídos al menos una vez a la semana en caso de perros sanos, ya que se eliminan de esta forma los microorganismos que pueden contener toxinas bacterianas.


O'Keefe's Working Hands - Crema regeneradora para manos 96g
- Manos Crema de Manos de trabajo de O'Keeffe ha sido especialmente desarrollado para las manos secas, ásperas y agrietadas .
- La fórmula inodoro, concentrada promueve el proceso de curación natural de la piel mediante la hidratación de la piel, ajustar el valor del pH y la conservación de la humedad .
- Manos de trabajo crema de manos de O'Keeffe se absorbe rápidamente y no deja película grasa.
- A diferencia de lo que se sentirá como en unos pocos días !
- Adecuado para todo tipo de piel .


Varillas de incienso Golden Nag Chandan 180g aroma a madera de sándalo 12 cajitas fragancia ambientador


Bourjois Volume Reveal Máscara de pestañas Tono 22 Ultra Black, 7.5 ml
- Máscara de pestañas que da volumen y definición durante 16 horas
- Viene con un espejo de aumento X3 que fácilita la aplicación
- Su fórmula negra perlada proporciona volumen sin grumos
- El cepillo con cerdas largas y cortas atrapa cada pestaña
- Libre de parabenos y apta para ojos sensibles y usuarias de lentes de contacto


Moroccanoil Treatment For All Hair Types Tratamiento Capilar - 25 ml
- Todo Tipo de Cabello
- Aceite de Argán, rico en Vitamina E que ayuda a hidratar y proteger el cabello.
- Número de modelo del producto: 2750
- 25 ml


Tahe Kerafusion Champú Post Alisador Fibra a Fibra con Keratina Pura y Oro Líquido, Acabado Liso Perfecto, 500 ml
- Su fórmula con activos alisa fibra a fibra
- Rellena las micro-irregularidades
- Consigue un liso perfecto, suave, sedoso y lleno de movimiento.
- KERAFUSION de TAHE, ha sido concebido para reparar cada zona de la fibra capilar del cabello según su grado de daño, reforzando y sellando la cutícula por la acción de la Keratina, el oro líquido y los taninos.
- Tamaños Existentes: 200 ml y 500 ml.


Marca Amazon - Belei Limpiador facial purificante para pieles ultrasensibles, 150 ml
- Limpiador facial purificante para pieles ultrasensibles
- Fórmula suiza sin perfume
- Limpia el maquillaje, las partículas de suciedad y el exceso de grasa
- Indicado para pieles sensibles, ya que ayuda a evitar las irritaciones cutáneas
- Los limpiadores faciales son ideales como parte de la rutina de limpieza habitual y están indicados para pieles grasas y sensibles. A continuación, aplica tu hidratante favorita
- Aplica a diario por las mañanas o noches para limpiar tu piel
- Aplica sobre la piel húmeda, masajea con suavidad el rostro y el cuello y aclara con agua tibia
- Producto fabricado en Suiza

Imágenes de Comentario critico el perfume
Si a ti te es más cómodo elegir de forma visual los productos, aquí puedes observar un montón de fotos de comentario critico el perfume. Haz click en una de las imágenes y entrarás a la adquisición online de colonia en concreto viendo sus funcionalidades y coste.