Eyeliner para principiantes
Localizar el perfume perfecto no tiene por qué razón ser un reto. Si buscas un nuevo perfume de autor, sabemos de qué forma ayudarte a reducir la selección. Así que así sea que estés comprando para ti o bien para alguien singular en tu vida, hallarás a continuación buenos productos y perfumes como eyeliner para principiantes, trucos maquillaje principiantes o trucos para eyeliner, que están aprobados por expertos para mujeres y hombres. Para entender mejor lo que quieres en una fragancia, piensa en las que has utilizado anteriormente, o bien en las que has sentido que te gustan (así sea que tus amigos, colegas o bien familiares usen fragancias que han dejado impresiones positivas). Mira las familias de fragancias a las que pertenecen estos olores, o bien sus notas. Cuando un fragancia pasa por la parte superior de la nariz y entra en el bulbo olfativo del cerebro, el cerebro interpreta el olor, casi como piezas de un rompecabezas, dice el famoso perfumista explicando por qué razón el perfume puede tener un efecto tan intenso en nuestros estados de ánimo y recuerdos. Esa información es llevada a la amígdala, donde se procesan las emociones, luego va a la parte del cerebro donde se forma la memoria.
Listado top ventas para Eyeliner para principiantes
Con esta de referencias vamos a mostrarte lo mejor en eyeliner para principiantes para el confort de tu salud. En este momento puedes encontrar lo mejor para tu cuerpo, pudiendo comparar entre las mejores marcas y modelos del mercado.

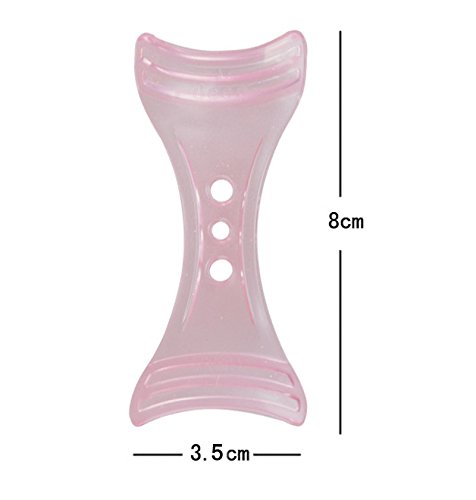
Eyeliner plantilla plantilla Shaper Eyeline maquillaje herramienta rosa
- Color: Pink.Material: ABS. Tamaño: 8 * 3. 5 cm.
- Mantenga estable y disminuir batidos al dibujar la línea del ojo.
- Dos tipos de curvas y ángulos en ambos lados de este bafle.
- Usted puede elegir un lado con el mejor efecto que te gusta al hacer para arriba.
- Una herramienta de maquillaje maravilloso para el principiante.


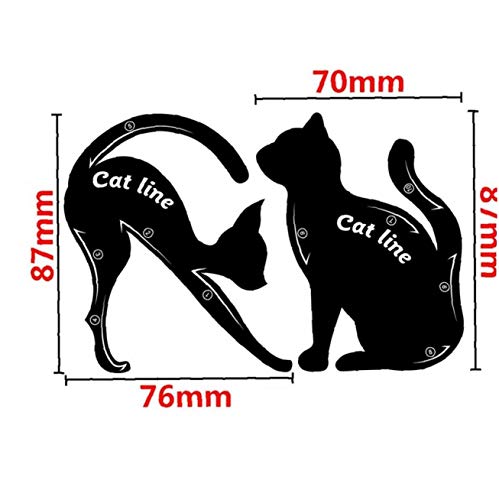
Maquillaje 2pcs Gato Eyeliner Plantillas De Pvc Ojos Ahumados Aplicadores Del Ojo De Gato Guía Liner Plantilla Para Principiantes
- Dos formas diferentes delineador plantilla-cada parte del gato puede ser utilizado placa de placa de sombra de ojos o delineador de ojos ahumado, por favor, ajuste la posición de los gatos de acuerdo a sus necesidades.
- Fácil de usar y guardar su tiempo este gato delineador plantilla es muy adecuado para principiante del maquillaje de los ojos, ayuda a tener una buena start.it es muy fácil de adquirir un delineador de ojos natural y preciosa, y ahorrar esfuerzos.
- Maravilloso don-dan a esta plantilla delineador de ojos de gato un regalo único a sus seres queridos, amante, novia, esposa, novia, madre.
- Diseño único con múltiples funciones, este gato plantilla de delineador de ojos es principalmente para facilitar dibujar sobre delineador de ojos, utilice esta forma única para crear su gato diferente delineador de ojos bastante.
- Reutilizable y fácil de limpiar material de la plantilla de delineador de ojos de gato es PVC respetuoso del medio ambiente, es seguro para la piel y puede ser reutilizado, y simplemente limpiar con agua o tejido.


shentaotao Herramienta De La Plantilla Plantilla Delineador Shaping Eyeline Maquillaje Kit De La Plantilla
- FUNCIÓN: Este kit de la plantilla le permite diseñar fácilmente, decorar y cuidar su línea de los ojos.
- DISEÑO: Le permite dibujar líneas de los ojos de una manera profesional, con un mínimo esfuerzo.
- Se adapta a cualquier forma de los ojos: flexible, fácil de usar y de hecho para adaptarse a cualquier forma de los ojos y el tamaño de los ojos.
- APLICACIÓN: Hacer que hace más fácil el maquillaje de ojos, maquillaje perfecta para principiantes.
- REUTILIZABLE: Nuestras plantillas Eyeline es reutilizable, hecho de materiales seguros y de calidad para el uso a largo plazo.


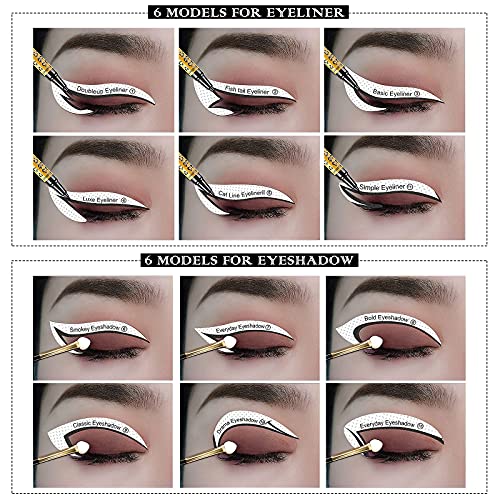
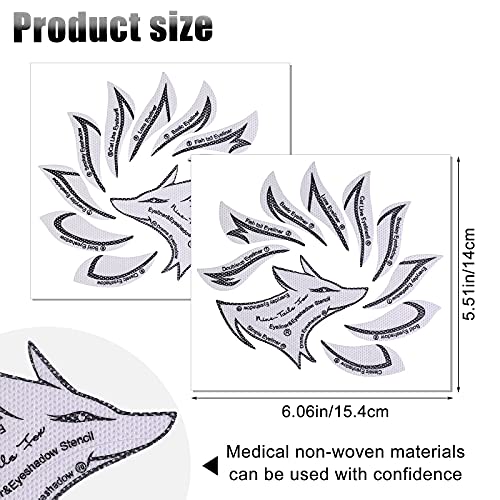
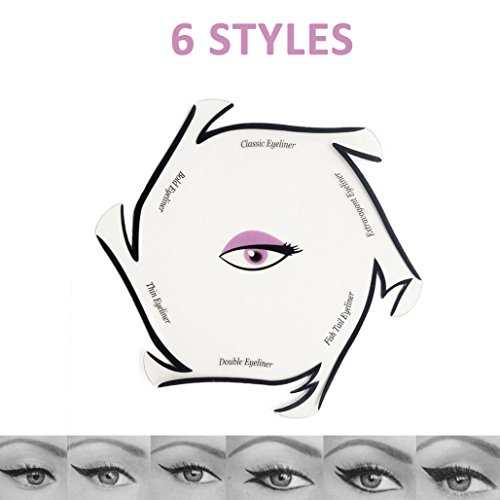
MWOOT 20 Piezas Plantilla Delineador de Ojos, Reutilizable Plantilla Eyeliner Sombra para Delinear Ojos, 12 Estilo Eyeliner Eyeshadow Stencils Template, Quick Herramienta Maquillaje para Principiantes
- Estilos ricos: cada plantilla tiene 6 modelos de delineador de ojos y 6 modelos de sombra de ojos. Incluyendo cola de pez, básico, línea de gato, delineador de ojos simple; Sombra de ojos ahumada, cotidiana, atrevida, clásica y dramática. Hacerlo más atractivo y satisfacer sus diferentes necesidades diarias.
- Suave y confiable: nuestras plantillas reutilizables están hechas de fibras no tejidas, suaves y duraderas, ecológicas y no tóxicas. Se puede aplicar de manera confiable a la mayoría de las pieles sin forzar la piel.
- Fácil de usar: fácil de pegar, solo coloque la plantilla ligeramente en el ojo y dibuje delineador de ojos o sombra de ojos a lo largo de su contorno. Crea efectos de maquillaje de ojos llamativos para ti.
- Ahorro de tiempo: con nuestras prácticas pegatinas de plantilla, puedes dibujar delineador de ojos y sombra de ojos profesionales en unos segundos y lucir increíble. Es una herramienta de maquillaje perfecta para principiantes y usuarios experimentados.
- Contenido del paquete: obtendrá 20 piezas de plantillas de delineador de ojos y sombras de ojos, un total de 20 hojas. Buen tamaño de 6.06 * 5.51 ″ /15.4*14 CM de cada plantilla.


Plantillas delineadoras para los ojos de plástico, color rosa, utensilios para maquillaje, para principiantes, 2 unidades
- Material: plástico. Color: rosa. Paquete: 2 unidades.
- Tamaño: Longitud: aproximadamente 8 cm. Ancho: aproximadamente 3,5 cm.
- Plástico resistente y duradero, seguro y no tóxico, sin olor peculiar, no daña la piel ni el pelo.
- Diseño sencillo, fácil y cómodo de usar, hace que delinear los ojos sea más fácil y rápido.
- Se recomienda lavarlo después de cada uso y mantenerlo limpio e higienizado. Instrumento esencial para maquilladores principiantes. Delineador de ojos para lograr unos hermosos ojos.

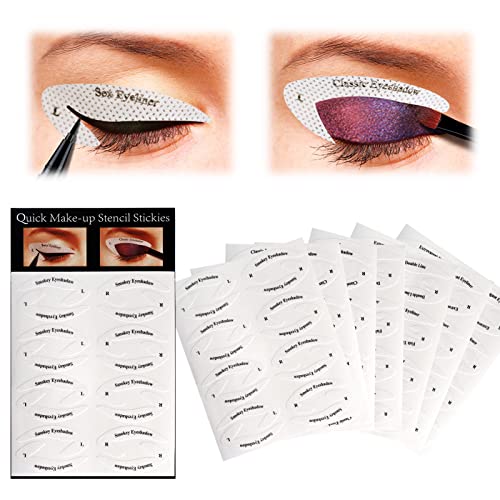
Plantilla para Delinear Ojos, Plantilla para Sombra de Ojos, 8Pcs Plantillas de Maquillaje para Ojos Pegatina, Cat Eyeliner Stencil Ojos Ahumados para Principiante
- Juego de maquillaje de ojos: obtendrá 8 plantillas de sombra de ojos, pegatinas de plantilla de delineador de ojos, 4 sombras de ojos (sombra de ojos clásica + sombra de ojos ahumada y 6 estilos de delineador de ojos (delineador doble + delineador de ojos de gato + delineador de ojos extravagante + delineador de ojos de cola de pez + delineador de ojos sexy + delineador de ojos fino), lata satisfaga cualquiera de sus necesidades de maquillaje de ojos.
- Material: hecho de tela no tejida, suave, cómodo y seguro, fácil de usar.
- Fácil de usar: controle el ángulo y la plantilla de maquillaje de ojos para adaptarse a cualquier forma y tamaño de ojos. Incluso si este es su primer tratamiento para los ojos, puede hacer que sus ojos se vean más hermosos.
- Fácil de quitar: respetuoso con el medio ambiente, débilmente pegajoso, no queda pegamento durante la extracción y no produce hormigueo.
- Amplia aplicación: este conjunto de herramientas de maquillaje de ojos es adecuado para cualquier entusiasta del maquillaje. El kit de molde para cejas puede reducir el tiempo que dedica al maquillaje. Este conjunto de herramientas para plantillas de maquillaje de ojos es adecuado para diferentes formas de ojos. Tiene plantillas para ojos izquierdo y derecho.


Conjunto Modelo de Eyeliner para el Eye-Liner Parfait por Blissany, Cat ojos, ojos Stencil 16 Styles, Double Wing, Extravagant Cat, Arabic Eyeliner de 2 piezas
- estarcido Eyeliner – el must-have para un eye-liner perfectamente perderse.
- Esto nunca ha sido tan fácil: sólo tiene que aplicar la plantilla y de dibujar la párpado. Debido a las diferentes diseños, hay para todos los gustos.
- Esta herramienta de maquillaje permite no sólo de ahorrar tiempo, sino también de los nervios – no de desenfoque, no de esquinas y líneas de Bellas incluso paupières
- Reutilizable y fácil de limpiar
- En razón de la talla y del peso del compañero ideal para viajar.


L´Oréal Paris Make Up Artist Superliner Flash Cat Eye, Eyeliner Líquido, Color Negro
- Eyeliner liquido negro con aplicador para un acabado perfecto
- Rabillo del ojo perfecto en una pasada
- Liner liquido negro intenso resistente al agua, ultra preciso
- Raya del ojo intensa y resistente al agua con un rabillo del ojo perfecto
- Aplicar el liner en el párpado superior y terminar el rabillo del ojo con el aplicador preciso


Maybelline New York - Eyeliner Curvitude Liner, Tono 01 Negro
- El primer eyeliner curvo de tono negro intenso, de punta súper precisa y fácil de aplicar para una mirada más definida e intensa en pocos minutos
- Diseñado para conseguir unos mejores resultados, su aplicador curvo es tan preciso que consigue pegarse a la línea de la pestañas para agrandar tu mirada
- Delínea a ras toda la línea de la pestaña creando una línea fina que agrandará excepcionalmente tu mirada y traza un rabillo para levantar la mirada
- Aumenta paulatinamente el grosor del trazo si quieres conseguir un resultado más intenso, efecto "cat-eye"
- Crearás una mirada súper definida, más grande y atractiva, con un tono ultraintenso y preciso que abraza tus pestañas y rellena todos los huecos


Rimmel London Exaggerate Automatic Eyeliner Waterproof - Delineador de Ojos Retráctil, Tono 001 Negro (Black), 0.28 gr
- Delineador líquido con punta de fieltro de precisión
- Fórmula líquida muy pigmentada que proporciona un look de ojos atrevido
- El aplicador, con máximo control, ayuda a crear una línea uniforme y definida alrededor del contorno del ojo
- Fórmula a prueba de roces, no se cuartea y resiste hasta 16 horas, eyeliner de larga duración
- Dermatológicamente y oftalmológicamente probado


Max Factor Masterpiece High Precision Eyeliner Delineador de Ojos Tono 01 Negro - 6 gr
- El lápiz de ojos líquido Masterpiece High Precisión de Max Factor aporta la intensidad de un delineador líquido y la precisión de un lápiz
- Su asombrosa punta en forma de pala dibuja líneas gruesas y finas para proporcionar dos looks totalmente diferentes y ajustados a tus necesidades: espectacular y elegante, que durarán día y noche
- Paso 1: para intensificar cualquier look de ojos rápidamente, presiona la punta en forma de cuña en la raíz de las pestañas dibujando puntos para crear el efecto de pestañas más densas
- Paso 2: para trazar una línea superior a lo largo de las pestañas superiores, inclina la cabeza hacia detrás en un pequeño ángulo, y apoya la mano en una superficie plana
- Ideal para crear precisión, longitud y volumen


L'Oréal Paris Perfect Slim Líquido Negro Intenso - 12 ml
- Perfilador líquido con trazo fino de color negro
- Punta de pluma extra fina para conseguir un trazo más delicado y elegante
- Forma ergonómica que se adapta a la forma de tu ojo
- Gracias a la punta de alta precisión dibuja un trazo preciso, intenso y modulable
- Aplicación fácil y rápida en una sola pasada


Onlyoily Delineador de ojos a prueba de agua, delineador líquido negro, resistente al agua, antiincrustante, delineador líquido de larga duración
- Extremidad fina: El aplicador ultra fino de la punta del cepillo, suave y liso, nunca daña su piel. Esbozar las líneas de los ojos con suavidad, desde la esquina del ojo hasta el final del ojo, para crear un contorno claro y estereoscópico. Para que los ojos se vuelvan más grandes y brillantes. Principiante también puede realizar la formación de una sola vez
- Completa tu look de femme fatale con este delineador en rotulador de larga duración. Disfrutarás de un resultado impecable hasta 12 horas sin que se difumine hacia los párpados
- Impermeable y resistente al sudor; delineador de ojos a prueba de agua, suave, el color se puede mantener durante todo el día.
- Fácil de usar: Buena ductilidad, coloreado uniformemente, flujo de líquido continuo, duradero de usar. Diseño de tamaño medio y ligero, hace que sea fácil de mantener y operar. Fácil de aplicar y controlar la forma de la línea del ojo con precisión. Cree líneas perfectamente limpias en cualquier momento
- Quitar rápidamente: La línea de vista mate es más fácil de quitar. Utilice una almohadilla de algodón con agua tibia o un poco de crema de eliminación de maquillaje, masajear la línea del ojo con suavidad durante unos segundos. Luego limpiar con la almohadilla de algodón, que desaparecerá sin manchas. Ahorre mucho tiempo para usted


NYX Professional Makeup Delineador de ojos Epic Ink Liner, Punta de pincel, Resistente al agua, Fórmula vegana, Negro
- Eyeliner con punta de pincel resistente al agua y de alta pigmentación, adecuado para líneas definidas y gran variedad de looks, óptimo para principiantes
- Versátil tono negro apto para cualquier color de ojos, color vivo y de larga duración
- Punta de pincel fina y flexible, controla el grosor de la línea variando la presión, para un resultado fino y natural o líneas gruesas y llamativas
- Aplicación suave y sin esfuerzo, fórmula vegana
- Contenido: 1x nyx professional makeup delineador de ojos epic ink liner, negro


Maybelline New York - Eyeliner Rotulador Líquido Hypereasy Color Negro, 0.6 gr
- Eyeliner HyperEasy Rotulador líquido
- Tu raya del ojo nunca fue tan fácil
- Agarre Hexagonal
- Línea contínua y sin hueco
- Delinea un trazo a ras de las pestañas superiores terminando con el rabillo del ojo; no estires el párpado mientras lo aplicas

Imágenes de Eyeliner para principiantes
Aquí tienes un montón de fotos de eyeliner para principiantes para que te hagas una idea y puedas seleccionar entre todos los tipos de colonia. Pincha con el ratón en una de las imágenes para ver la ficha entera del artículo y su precio.