Cuantos ml tiene una muestra de perfume
Hay muchos perfumes en el mercado y en cualquier tienda de venta al público on line. Sin embargo, no se puede estar seguro de su longevidad y calidad. Dale una oportunidad a referencias tales como cuantos ml tiene una muestra de perfume, cuantos perfumes tiene calvin klein o bien cuantos anos tiene la marca versace y ya verás como olerás mucho mejor!. Una forma de saber si un perfume te gustará de forma segura es probar los que han existido a lo largo de años y han resistido el paso del tiempo. Fragancias conocidas como Daisy de Marc Jacob y el Número cinco de Chanel tienen una religión que sigue una explicación: son pasmantes. El poder de una olor radica en algo más que en su fragancia. Los mejores perfumes transportan: pueden levantar el ánimo, servir de recordatorio de un ser querido o bien prosperar tenuemente el impacto de un conjunto.
Listado top ventas para Cuantos ml tiene una muestra de perfume
Avanza por esta enumeración de distintos productos como cuantos ml tiene una muestra de perfume, lo mejor para poder cuidar a tu salud. Toma conocimiento de que para encontrar sinfín de opciones para comprar lo mejor para tu salud, estás en uno de los mejores sitios web de la red.

Cecotec Difusor de aromas PureAroma 550 Connected White Woody. Capacidad 500ml, Pantalla LED, Altavoz, Control por bluetooth, App, Temporizador 12h, 3 Modos de funcionamiento, Cobertura 30m2
- Difusor de aromas con una gran capacidad de 500 ml que permite su uso de manera prolongada sin tener que rellenar el depósito. Además, cuenta con un gran área de cobertura de 30 m², su humidificación y su buen olor gracias a los aceites esenciales llegarán a todos los rincones de la estancia en la cual sea ubicado.
- Uso idóneo para aromaterapia, su salida de vapor es de 25 ml/h. Respira un agradable aroma en todo momento y disfruta de tus momentos de relajación.
- Controla todas sus funciones y configuraciones desde tu smartphone gracias a su aplicación. Además podrás reproducir tus canciones y grupos favoritos gracias al altavoz que lleva incorporado.
- Posee una pantalla LED que muestra la hora, gracias a la cual se pueden configurar otras funciones del difusor como la alarma, los modos o el temporizador. Su temporizador de hasta 12 horas permite seleccionar el tiempo de funcionamiento deseado, tras el cual se apagará. Cuenta con 3 modos de funcionamiento: Low, Medium y High, gracias a los cuales se puede regular la intensidad de la salida de vapor.
- El difusor de aromas tiene la función despertador, gracias a la cual es posible configurar una hora determinada y que el aromatizador nos avise. Sus 7 colores LED colaboran a lograr un perfecto ambiente para los momentos de relajación. Es posible dejar un color fijo o de manera aleatoria.


Neo Peques | Mocosytos Jarabe Infantil Para la Tos Seca y Productiva | Expectorante | Cuida la Garganta de Niños | 150 ml | Sabor Frambuesa | Pino, Liquen de Islandia
- 🥇 MÁXIMA CALIDAD: NEOVITAL HEALTH es una compañía nacional con proyección internacional comprometida en desarrollar soluciones naturales para mejorar la salud de las personas. NEOVITAL HEALTH centra todos sus esfuerzos en la innovación de sus productos y en la eficacia de sus preparados naturales con el principal objetivo de ayudar y mejorar la calidad de vida. Neovital lleva más de 30 años como líder del sector de los complementos alimenticios y está presente en miles de farmacias españolas
- ⭐⭐⭐⭐⭐ En Neovital podrás encontrar una magnífica gama de productos para tu salud y la de tus pequeños. Nuestras marcas, marcas como Neo Peques, Mico Neo o Reishi Neo; son sinónimo de calidad y millones de personas disfrutan de la mejor calidad cada año. Fabricamos una amplia variedad de remedios naturales que trabajan de forma específica según cada necesidad. Busca en Amazon nuestras marcas y encontrarás lo que necesitas para ser Feliz.
- 💚 COMPOSICIÓN: Producto Natural formulado con MALVA, que protege la mucosa respiratoria, reduce la inflamación y la irritación, facilita la respiración y disminuye la tos productiva. Contiene PINO, expectorante natural. Además destacamos también que lleva DROSERA y GORDOLOBO, antitusivos indicados para la tos espasmódica e irritativa.
- 📝 CARACTERÍSTICAS y MODO DE EMPLEO: Tomar 0,5 ml/kg de peso corporal. Dosis diaria máxima: 20 ml. Mejora la fluidez respiratoria, elimina la mucosidad y calma la tos seca y productiva. Jarabe infantil con agradable sabor a frambuesa, elaborado a base de extractos vegetales, aminoácidos y oligoelementos. Apto a partir de los 12 meses. Sin alérgenos, sin GMO, sin nanomateriales.
- 🚨 ATENCIÓN AL CLIENTE PARA TI: Neovital Health pone a tu disposición el Mejor Equipo Farmacéutico de España. Que trabaja cada día con el máximo rigor científico para contribuir al bienestar de la sociedad uniendo naturaleza e innovación. Donde se estudia, de forma incansable, nuevas aplicaciones de los principios activos naturales que puedan atender un amplio espectro de necesidades de la salud. 📩 Si tienes alguna duda sobre los productos, contáctanos y pregúntamos. ¡Estamos para Ayudarte!


SUAVINEX Neceser Tela de Viaje para Bebés con Baby Cologne, Loción Hidratante, Crema Pañal y Gel-Champú Espumoso, Formato Viaje, Rosa, 4 Productos
- Precioso neceser de tela formato viaje con todos los productos básicos para el cuidado de tu bebé: Gel-Champú Espumoso 100ml + Crema Pañal 75ml + Nueva Baby Cologne 500ml + Loción Hidratante 100ml.
- Neceser de cosmética de bebé apto para pieles sensibles. Para bebés +0 meses.
- Nueva Baby Cologne 50ml: con su fórmula baja en alcohol, es un aroma fresco y delicado, con unos toques de notas cítricas y esencias de flores blancas y almizcles.
- Gel-Champú Espumoso 100ml - Limpia con delicadeza la piel y el cabello del bebé. No pica en los ojos. con aroma a la fragancia Suavinex Baby Cologne.
- Loción Hidratante 100ml - Nutre en profundidad la piel del cuerpo del bebé.
- Crema Pañal 75ml - Protege de posibles irritaciones provocadas por el uso del pañal.
- Tu bebé siempre limpio y fresquito con nuestros productos de cosmética infantil.
- Neceser de tela ideal para llevar de viaje.
- Nuestros envases de cosmética (tubos y botellas) están fabricados con material biobasado que proviene de materias primas renovables: caña de azúcar de origen sostenible.
- Hemos cambiado el diseño de nuestros neceseres. Puede que recibas un neceser con un diseño ligeramente diferente al de la imagen.


VEGCOO 6PCS Atomizador Perfume Recargable, Mini Spray de Perfume Portátil, Botella Vacío Pulverizador Viaje 5ml (A)
- ✿ 【Color】 Incluye 6 botellas de spray de niebla fina de 5 ml de diferentes colores, puede contener diferentes perfumes y no mezclarse.
- ✿ 【Material】: la botella de atomizador de perfume está hecha de aluminio, resistente y duradera, no es fácil de rayar y filtrar.
- ✿ 【Fácil de llenar】: la parte inferior con un puerto de llenado, solo necesita alinear el tubo de la botella de perfume y luego presionarlo para llenarlo. Adecuado para el diámetro del tubo inferior a 3 mm, la longitud del tubo superior a 7 mm.
- ✿ 【Ligero y conveniente】: las mini botella atomizador de perfume son de tamaño pequeño y se pueden colocar fácilmente en su bolso para facilitar su transporte.
- ✿ 【Amplia aplicación】: el atomizador de fragancia es adecuado para viajes, vacaciones, campamentos, viajes de negocios, uso diario, etc. Es el mejor regalo para el festival.


L'Oréal Paris Dermo Expertise Revitalift Filler con ácido hialurónico Rutina - Crema día y Crema de Noche, 50 ml/unidad
- Crema de día anti arrugas para pieles maduras
- La piel se redensifica y el volumen del rostro está visiblemente restaurado
- Su fórmula incluye una alta concentración de ácido hialurónico
- Testado bajo control dermatológico; apto para todo tipo de pieles, incluso las más sensibles
- Aplicar por la mañana sobre el rostro y cuello previamente limpios.

![Yizhao Ambar Frasco Cuentagotas Cristal 30ml, Botellas Cuentagotas con [Pipeta Cuentagotas Cristal], para Aceite Esencial, Masaje,Fragancia, Aromaterapia, Laboratorio, E-Líquidos - 6Pcs Yizhao Ambar Frasco Cuentagotas Cristal 30ml, Botellas Cuentagotas con [Pipeta Cuentagotas Cristal], para Aceite Esencial, Masaje,Fragancia, Aromaterapia, Laboratorio, E-Líquidos - 6Pcs](https://www.iesribera.es/pics/2020/09/29/yizhao-ambar-frasco-cuentagotas-cristal-30ml-botellas-cuentagotas-con-pipeta-cuentagotas-cristal-para-aceite-esencial-masajefragancia-aromatera-80648.jpg)
Yizhao Ambar Frasco Cuentagotas Cristal 30ml, Botellas Cuentagotas con [Pipeta Cuentagotas Cristal], para Aceite Esencial, Masaje,Fragancia, Aromaterapia, Laboratorio, E-Líquidos - 6Pcs
- [30ML Marrón Frascos Goteros de Vidrio] Frascos de vidrio vacía es ámbar, Está diseñado para proteger el aceite esencial de los rayos UV. Excelente sellado, nunca fugas de líquido. Botellas lavables
- [Usar Para] Difusor de aceites esenciales, masaje, aromaterapia, aceite de fragancia, frascos cuentagotas de laboratorio, e-líquido.
- [Tamaño Portatil] ancho 33 mmX alto 106 mm (1.3x 4.17 in.) Peso neto: 51 Gramos. 0.04ml un gotero. La gorra es antirrobo de diseño
- [El Paquete Contiene] 12 Frascos Goteros de Vidrio 30ml + 12 Pipeta Cuentagotas Cristal + 2 más 3 ml de pipetas de plástico gotero + 2 mini embudos de plástico
- [Servicio de Calidad] Listo para responder en 24 horas. Garantizamos la calidad del producto que usted compra. El único vendedor:One Trillion Network


Moussel Gel Líquido Classique con Aceites Esenciales Naturales - Paquete de 8 x 600 ml - Total: 4800 ml
- Gel de ducha Moussel Clasico
- Mantiene la textura e hidratación natural
- Aporta frescor y bienestar
- Tiene textura cremosa
- Tiene una textura cremosa

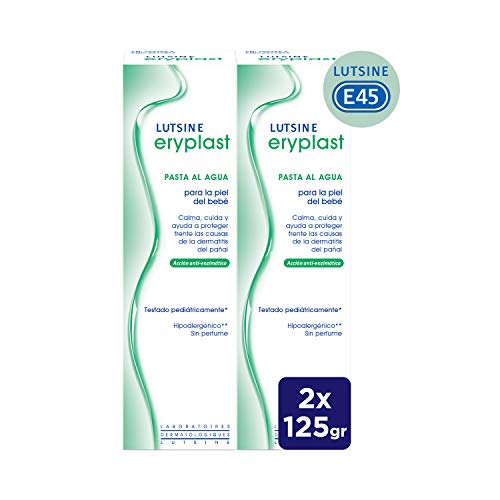
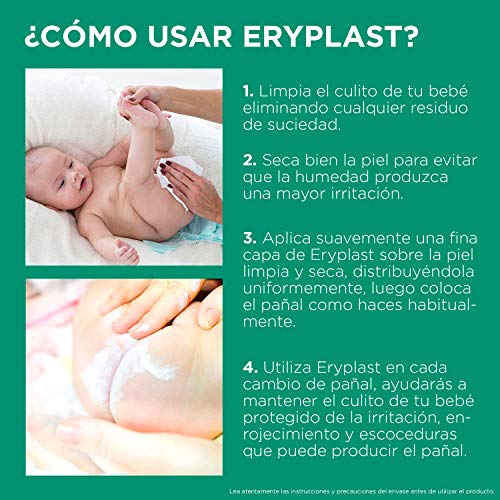
Eryplast Lutsine E45 - Pasta al Agua Crema Pañal Bebé 2 x 125 ml
- Pasta al agua para la prevención y tratamiento de la dermatitis del pañal
- Calma, cuida y ayuda a proteger frente las causas de la dermatitis del pañal; acción anti-enzimática
- Gracias al óxido de zinc, produce una barrera absorbente y no oclusiva capaz de evitar las infecciones bacterianas
- Colabora con la cicatrización y alivia el culito del bebé
- Su uso diario proporciona una protección suave y eficaz de la delicada piel del bebé


GANADOR 2020* Crema Facial de Acido Hialuronico Puro ORGÁNICA 50 ml - Crema Antiarrugas para Mujer con Aloe Vera y Vitamina E - Usar con un Serum Facial - Cremas Faciales para Contorno de Ojos
- ✅ CREMA FACIAL ANTI ARRUGAS CON ÁCIDO HIALURÓNICO ALTAMENTE EFECTIVA: esta combinación efectiva de acido hialuronico multimolecular actúa contra los signos del envejecimiento de la piel con un complejo antienvejecimiento de efecto triple desarrollado científicamente: 1. Alisamiento instantáneo de las arrugas superficiales, 2. Mejora general de la estructura de la piel; 3. Beneficios de larga duración en la reparación total de la edad.
- ✅ PIEL RADIANTE Y JOVEN: el acido hialuronico vegano combina ingredientes orgánicos nutritivos en una crema antiarrugas eficaz y científicamente probada que reduce visiblemente las arrugas, elimina las deficiencias de hidratación y recobra la elasticidad de la juventud. Una crema antiarrugas hidratante perfecta para mujer. Un tratamiento rico y natural para el cuidado de la piel de la cara, el contorno de ojos, el cuello y el escote.
- ✅ INGREDIENTES ORGÁNICOS SELECTOS: el aloe vera hidratante, el zumo de coco rico en nutrientes, la manteca de cacao profundamente nutritiva y el aceite de argán cargado de vitaminas completan esta exclusiva fuente de energía para la belleza facial. El elegante recipiente de vidrio violeta protege los nutrientes contra la desintegración, prolongando así la efectividad del producto. *El ganador en la comparación de 2020 del institut-produktbewertung.de, categoría: crema ácido hialurónico.
- ✅ CALIDAD PREMIUM: producto cosmético ecologico natural único fabricado en Alemania y probado dermatológicamente en probadores humanos independientes. 100% SEGURO, VEGANO Y SIN CRUELDAD ANIMAL. Sin ingredientes dañinos. Perfectamente adecuado como crema antiarrugas y para la delicada zona del contorno de ojos. Para obtener los mejores resultados posibles, combinarlo con nuestro serum de ácido hialurónico orgánico.
- ✅ NUEVO: COMPRA 1 PRODUCTO. PLANTA 1 ÁRBOL. OBTÉN RESULTADOS o recupera tu dinero: impulsados por tu satisfacción, nos esforzamos por ofrecerte excelentes productos. Lo verás en nuestros ingredientes efectivos de primera calidad, altos estándares de calidad y en nuestra excelente atención al cliente. Si, aun así, no estás satisfecho, contáctanos antes de 30 días desde tu compra y te devolveremos tu dinero. Quiérete a ti y a nuestro planeta. ¡Elige Satin Naturel!

Imágenes de Cuantos ml tiene una muestra de perfume
Si a ti te es más cómodo elegir de forma visual los artículos, puedes observar aquí una galería de imágenes de cuantos ml tiene una muestra de perfume. Pincha con el ratón una de las fotos y accederás a la compra online de perfume en concreto viendo sus atributos y costo.




















![Yizhao Ambar Frasco Cuentagotas Cristal 30ml, Botellas Cuentagotas con [Pipeta Cuentagotas Cristal], para Aceite Esencial, Masaje,Fragancia, Aromaterapia, Laboratorio, E-Líquidos - 6Pcs Yizhao Ambar Frasco Cuentagotas Cristal 30ml, Botellas Cuentagotas con [Pipeta Cuentagotas Cristal], para Aceite Esencial, Masaje,Fragancia, Aromaterapia, Laboratorio, E-Líquidos - 6Pcs](https://www.iesribera.es/pics/2020/09/29/yizhao-ambar-frasco-cuentagotas-cristal-30ml-botellas-cuentagotas-con-pipeta-cuentagotas-cristal-para-aceite-esencial-masajefragancia-aromatera-80648-2.jpg)
![Yizhao Ambar Frasco Cuentagotas Cristal 30ml, Botellas Cuentagotas con [Pipeta Cuentagotas Cristal], para Aceite Esencial, Masaje,Fragancia, Aromaterapia, Laboratorio, E-Líquidos - 6Pcs Yizhao Ambar Frasco Cuentagotas Cristal 30ml, Botellas Cuentagotas con [Pipeta Cuentagotas Cristal], para Aceite Esencial, Masaje,Fragancia, Aromaterapia, Laboratorio, E-Líquidos - 6Pcs](https://www.iesribera.es/pics/2020/09/29/yizhao-ambar-frasco-cuentagotas-cristal-30ml-botellas-cuentagotas-con-pipeta-cuentagotas-cristal-para-aceite-esencial-masajefragancia-aromatera-80648-3.jpg)
![Yizhao Ambar Frasco Cuentagotas Cristal 30ml, Botellas Cuentagotas con [Pipeta Cuentagotas Cristal], para Aceite Esencial, Masaje,Fragancia, Aromaterapia, Laboratorio, E-Líquidos - 6Pcs Yizhao Ambar Frasco Cuentagotas Cristal 30ml, Botellas Cuentagotas con [Pipeta Cuentagotas Cristal], para Aceite Esencial, Masaje,Fragancia, Aromaterapia, Laboratorio, E-Líquidos - 6Pcs](https://www.iesribera.es/pics/2020/09/29/yizhao-ambar-frasco-cuentagotas-cristal-30ml-botellas-cuentagotas-con-pipeta-cuentagotas-cristal-para-aceite-esencial-masajefragancia-aromatera-80648-4.jpg)
![Yizhao Ambar Frasco Cuentagotas Cristal 30ml, Botellas Cuentagotas con [Pipeta Cuentagotas Cristal], para Aceite Esencial, Masaje,Fragancia, Aromaterapia, Laboratorio, E-Líquidos - 6Pcs Yizhao Ambar Frasco Cuentagotas Cristal 30ml, Botellas Cuentagotas con [Pipeta Cuentagotas Cristal], para Aceite Esencial, Masaje,Fragancia, Aromaterapia, Laboratorio, E-Líquidos - 6Pcs](https://www.iesribera.es/pics/2020/09/29/yizhao-ambar-frasco-cuentagotas-cristal-30ml-botellas-cuentagotas-con-pipeta-cuentagotas-cristal-para-aceite-esencial-masajefragancia-aromatera-5.jpg)