Reacciones alergicas a los desodorantes
Nos agrada pensar que el perfume es la cereza sobre el helado, el toque final que une tu mirada, gracias a la activación de nuestros sentidos con reacciones alergicas a los desodorantes, desodorantes axe o desodorantes bio. Mas no se puede negar que comprar una nueva olor puede ser una experiencia desafiante (sin mencionar el dolor de cabeza). Tratándose de olores, trata de guardarlas en una habitación seca - como su dormitorio, en lugar del baño - y lejos de los radiadores y alféizares de las ventanas. Si su fragancia ha alterado de color, o bien el líquido se ha vuelto más fino o más espeso, entonces probablemente se ha apagado. Otra señal reveladora está en el olor, evidentemente. De cualquier forma, si buscas una fragancia verdaderamente única que haga que la gente se dé la vuelta solo para tomar otra agradable bocanada, entonces echa un vistazo a nuestra guía de fragancias para hombres y mujeres - de nosotros para ti.
Listado top ventas para Reacciones alergicas a los desodorantes
Deseamos que con este listado de productos encuentres reacciones alergicas a los desodorantes al mejor precio y con la calidad óptima para el bienestar y cuidado de tu bienestar. Nuestro objetivo es que podrás encontrar las mejores opciones y precios de la totalidad de lo que necesitas para , ofreciéndote la opción de descubrir numerosas modelos y marcas.

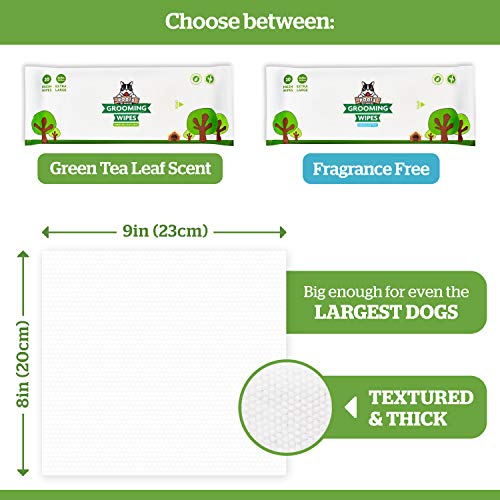
Pogi's Grooming Wipes Paquete de Viaje - 240 toallitas desodorantes para Perros - No perfumadas, Naturales, Extra Grandes, Biodegradable
- Ingredientes naturales – Aloe vera, vitamina E, y Awapuhi hawaiano que ayudan a limpiar, refrescar y acondicionar dándole al pelaje un brillo saludable al mismo tiempo. Perfectas para eliminar la suciedad y el olor entre baños.
- Toallitas extra grandes (20 x 23 cm) – Nuestras toallitas para mascotas están hechas incluso para los perros más grandes, y son lo suficientemente gruesas para los pelajes más duros.
- Ecológicas – Oeko-Tex Fabricadas con madera de bambú sostenible las toallitas se desintegran rápidamente, manteniendo parques, océanos, y vertederos libres de residuos.
- Hipoalergénicas – Completamente libres de parabenos, alcohol, clorina & químicos agresivos.
- 240 Toallitas húmedas paquete de viaje - 12 paquetes resellables de 20 - Suministro para 2+ meses


PACK X4 Old Spice Original Desodorante en Barra para Hombres, 50 ml
- La exquisita fragancia de Old Spice te hará inolvidable, como si fueras el centro del mundo
- El desodorante Old Spice es como un campo de fuerza que repele las marcas blancas y las manchas amarillentas
- El desodorante Old Spice dura todo el día, porque se suele tener el mismo cuerpo para todo el día
- La tecnología de Old Spice evita que la fragancia desaparezca a lo largo del día, para que huelas bien hasta que vuelvas a casa


O³ Piedra de Alumbre Desodorante - 3 Unidades de 60g -100% Natural - Sin Aluminio - sin Parabenos - Desodorante Natural Hombre y Mujer
- 🙆 ¿ESTÁS CANSADO DE LOS RASTROS DE SUDORACIÓN? ¿Necesitas un desodorante 100% natural? Desodorante de piedra de alumbre Lola Nature es para ti. No contiene parabenos ni cloruro de aluminio. Sin alcohol y sin perfume
- 💎 Piedra de alumbre Lola Nature se utiliza para limitar la transpiración, prevenir la fermentación y neutralizar las bacterias que causan los olores. Este producto no lleva el riesgo de reacción alérgica y fácil de usar: aplícalo directamente después de la ducha en la piel húmeda, las axilas, los pies, las manos huecas, la frente o el cuello
- 🔝Piedra de alumbre aplicada en la piel cierra los poros y reafirma la piel. Además tiene muchas otras virtudes: una solución contra los vellos encarnados, un afeitado natural, un remedio contra el herpes labial
- 💶 Solución económica: una piedra de alumbre de 60 g sirve para aproximadamente un año. ¡Durante este tiempo normalmente gastas 6-12 desodorantes tradicionales!
- 💯 SATISFACCIÓN GARANTIZADA - Satisfecho o Rembolsado - GARANTÍA DE POR VIDA! Si tienes algunas preguntas, contáctanos por Amazon, respondemos a todos mensajes dentro de 24 horas


Desodorante natural de soda Ben&Anna – 100% de aluminio, sin crueldad, vegano, certificado NATRUE, con manteca de karité orgánica y bicarbonato de sodio, fabricado en Alemania, pomelo rosa, 60 g
- Perfiles de olor agradables: cómodos, no secados, sostenibles y agradables para los ojos y la nariz. Tu cuerpo no se arrepentirá de probar uno de nuestros muchos aromas.
- Protege contra la humedad y el olor, antiolor y antiolor, nunca graso o pegajoso, sin aluminio, PEG, parabeno o ftalato. Mantiene tus axilas secas, no más puntos húmedos. Vegano, sin crueldad animal y sin gluten, sin sal.
- Desodorantes naturales: el desodorante Ben y Anna es un producto desodorante vegano que es tan antitranspirante natural como puedes encontrar. Hombres y mujeres que quieren lo mejor para su piel. Se siente como la manteca de karité suave y la manteca corporal de coco.
- Desodorante orgánico: todos nuestros desodorantes nativos son completamente libres de aluminio. Son orgánicos y están hechos de aceites esenciales naturales. Ben & Anna son mucho más suaves para la piel que el spray de alcohol y el desodorante de cristal.
- Fácil de usar: simplemente empuja la parte inferior del tubo con el pulgar hasta que el desodorante salga un poco y extiéndelo sobre las axilas dejando una fina capa de nuestro desodorante en la piel. No más spray de sal natural o spray corporal para mujer.


BACTEMIA MICRODOR CHAMPU 500ml eliminador de Olor Corporal para Perros y Gatos (Apto para Cachorros y Pieles sensibles)
- Ideal para tu mascota
- Material de calidad
- Muy resistente


Desodorante natural en barra Lavilin Bio Balance para 72 horas, 50 ml
- Los desodorantes naturales más vendidos: libres de paraben, alcohol y aluminio.
- Elimina el olor a sudor por hasta 72 h.
- Contiene ingredientes naturales activos, extractos de plantas, probiota, vitaminas y minerales.
- Aroma fresco y limpio. Unisex.
- No ha sido probado en animales.

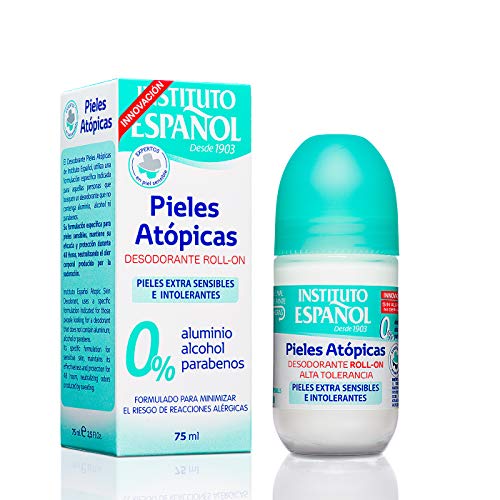
Instituto Español - Desodorante Roll-On Piel Atópica, 75 ml
- Tipo de Piel: Sensible /, Atópica
- Formulación: Hipoalergénico, Sin Parabenos, Sin Alcohol
- Formato: Roll-on

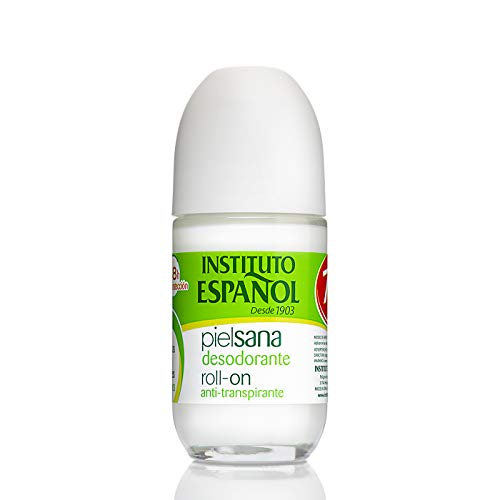
Instituto Español 1020-02565 Piel Sana Desodorante Roll On - 75 ml
- Tipo de producto: Desodorante roll on
- Marca: Instituto Español
- Género: Unisex Adulto


Dove Gel De Ducha Coco y Almendras - 4 Paquetes de 500 ml - Total: 2000 ml
- El gel de ducha Ritual Restaurador Dove Secretos Hidratantes contiene aceite de coco y leche de almendras que desprenden una fragancia que envuelve tus sentidos
- Gel de ducha inspirado en los rituales de belleza de las mujeres de la India
- Hidrata la piel no solo en la superficie, pero también la nutre en profundidad (dentro de la capa córnea)
- Proporciona una piel más suave, restaurada y cuidada desde la primera ducha
- Su exclusiva tecnología NutriumMoisture ayuda a restaurar la barrera natural de la piel
- Para obtener mejores resultados, combina nuestro gel de ducha Ritual Restaurador con nuestras lociones corporales, champús y acondicionadores para el cabello de la gama Dove Secretos Hidratantes


Nenuco Agua de Colonia recomendado para bebés,fragancia original - 600 ml
- El agua de colonia nenuco con su fragancia original de siempre cuidará de vuestro bebé y de toda la familia a diario
- Disfrutad de esta especial fragancia que, junto con vuestros mimos que tanto le gustan, estimulará sus sentidos y creará momentos únicos
- Ph neutro: el ph neutro de la colonia respetará la suavidad de su delicada piel
- su fórmula ha sido clínicamente testada bajo estricto control dermatológico; nenuco garantiza la idoneidad de sus productos con estudios realizados en laboratorios independientes
- Formato de 600 ml


MENFORSAN Champú Perros Aloe Vera - 1 Litro
- Champú de máxima calidad para perros con aloe vera indicado para pieles con irritaciones, picaduras de insectos, erupciones y eczemas.
- Proporciona brillo y suavidad, hidrata en profundidad y es muy útil para reparar pelajes estropeados. Apto para uso frecuente en todo tipo de razas y pelajes.
- PH adaptado.
- Apto para uso frecuente.

Imágenes de Reacciones alergicas a los desodorantes
Te mostramos aquí un montón de fotos de reacciones alergicas a los desodorantes para que te formes una idea y puedas escoger entre todos los modelos de colonia. Pincha con el ratón en una de las fotografías para ver la ficha íntegra del artículo y su coste.