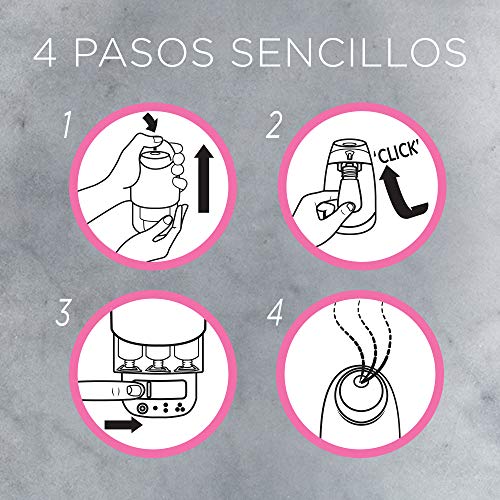
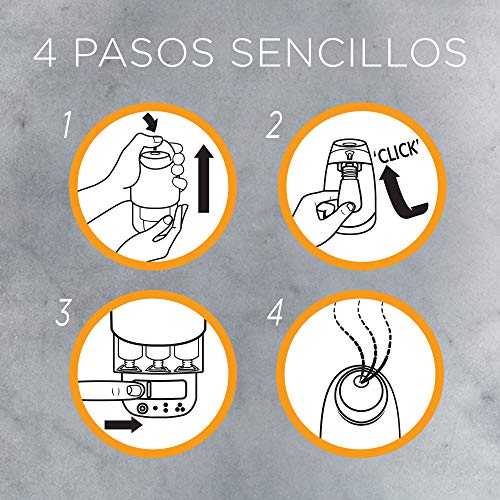
Air wick vapor
Si no estás seguro del género de aroma que te gusta, o bien del destinatario del perfume, los tipos de aroma o bien las "familias" pueden darte alguna orientación. Con las fragancias tanto para hombres como para mujeres, las palabras de tendencia a las que hay que prestar atención son: floral, fresca, afrutada, cítrica, oriental, amaderada y picante. Con lo dicho previamente, esperamos que alguna de nuestras referencias como air wick vapor, planchas de vapor pelo o bien planchas de vapor de pelo te puedan valer. Teniendo en cuenta estos factores, hemos mirado algunos de los mejores perfumes del mercado que son nuevos y clásicos para obtener la primicia de de qué manera oler mejor. Tanto si te agrada algo resbaladizo y cálido que se sienta en la piel como el terciopelo invisible o si eres más del tipo burbujeante y floral, tus gustos están seguramente representados en las variadas y encantadoras opciones de abajo. Si deseas mostrarle a alguien un regalo, puede ser una colonia. Un buen perfume puede darte todas y cada una de las cualidades para sentirte dominante, optimista y refulgente en tu personalidad y apariencia. Conque resumimos una lista de las mejores colonias que pueden traer un cambio positivo en ti.
Listado top ventas para Air wick vapor
Avanza por esta gama de multiples productos como air wick vapor, lo mejor para cuidar a tu bienestar. Si quieres encontrar sinfín de opciones para comprar lo mejor para tu cuerpo, te encuentras en uno de los mejores sitios web de la red.

Air Wick Diffuseur d'Huiles Essentielles Essential Mist + 1 Recharge Parfum Lavande 20 ml
- Transforma las fragancias refinadas con aceites esenciales naturales en una niebla ligera e inhaladora
- Ideal para todas tus habitaciones: la posibilidad de ajustar la frecuencia de difusión permite adaptar Air Wick Essential Mist a todas las habitaciones
- Gracias a su tecnología avanzada, el dispositivo emite agradables ondas de niebla perfumadas con fragancias cautivadoras
- Sobre la base del uso del difusor en posición mínima, una recarga ofrece hasta 45 días de fragancia
- Contiene 1 difusor + 1 recarga + 2 pilas


Air Wick Essential Mist Aparato Difusor De Aceites Esenciales Y 2 Recambios Con Rosa
- Aparato difusor de aceites esenciales Air Wick Essential Mist y 2 recambios
- Fragancia de rosa calmante, evoca la tranquilidad de un jardin de rosas
- Transforma aceites esenciales naturales en vapor para envolvernos de las fragancias que más nos gustan
- El vapor se libera en intervalos regulados durante 8 h, y se apaga hasta la misma hora del día siguiente, liberando una sutil fragancia
- Intensidad de fragancia personalizable, cada recambio tiene una duración de hasta 45 días, disfruta de un aroma duradero en tu hogar


Air Wick Essential Mist Aparato Difusor De Aceites Esenciales Y 2 Recambios Con Lavanda
- Aparato difusor de aceites esenciales Air Wick Essential Mist y 2 recambios
- Fragancia lavanda y camomilla tranquilizante, vive una experiencia totalmente sensorial a través de los campos de lavanda con una suave brisa de frutas y maderas
- Transforma aceites esenciales naturales en vapor para envolvernos de las fragancias que más nos gustan
- El vapor se libera en intervalos regulados durante 8 h, y se apaga hasta la misma hora del día siguiente, liberando una sutil fragancia
- Intensidad de fragancia personalizable, cada recambio tiene una duración de hasta 45 días, disfruta de un aroma duradero en tu hogar


Air Wick Essential Mist 3 Recambios Con Peonia
- 3 recambios para ambientador difusor de aceites esenciales Air Wick Essential Mist
- Fragancia de peonia y jazmín equilibrante, un aroma delicado basado en flores blancas recién cortadas
- Transforma aceites esenciales naturales en vapor para envolvernos de las fragancias que más nos gustan
- El vapor se libera en intervalos regulados durante 8 h, y se apaga hasta la misma hora del día siguiente, liberando una sutil fragancia
- Intensidad de fragancia personalizable, cada recambio tiene una duración de hasta 45 días, disfruta de un aroma duradero en tu hogar


Air Wick Essential Mist Recambio Ambientador fragancia Felicidad: piña, melocotón y menta salvaje
- Difusor de aceites esenciales Air Wick Essential Mist; déjate envolver con las fragancias que más te gustan
- El vapor se libera en intervalos regulados durante 8h, y se apaga hasta la misma hora del día siguiente
- Frecuencia regulable; puedes escoger entre tres niveles de intensidad (baja, media y alta) que permiten el control de la fragancia emitida
- Es portable y discreto gracias a su funcionamiento con pilas y su pequeño tamaño, permitiéndote así colocarlo donde quieras
- Aroma Felicidad: piña, melocotón y menta salvaje


Air Wick - Essential Mist Recambio Ambientador fragancia Felicidad (piña, melocotón y menta salvaje), 94 gr
- Difusor de aceites esenciales Air Wick Essential Mist, déjate envolver con las fragancias que te gustan
- El vapor se libera en intervalos regulados durante 8 h, y se apaga hasta la misma hora del día siguiente
- Frecuencia regulable; puedes escoger entre tres niveles de intensidad (baja, media y alta) que permiten el control de la fragancia emitida
- Es portable y discreto con su funcionamiento con pilas y su pequeño tamaño, permitiéndote así colocarlo donde quieras
- Aroma Felicidad: piña, melocotón y menta salvaje


Air Wick Essential Mist - Recambio de ambientador difusor, esencia para casa con aroma Revitalizante
- Recambio para Air Wick Essential Mist, el ambientador difusor que transforma aceites esenciales naturales en vapor
- Aroma Revitalizante, toma un momento para revitalizarte con la fragancia sutil de melón, salvia y albahaca
- El vapor se libera en intervalos regulados durante 8h, y se apaga hasta la misma hora del día siguiente; frecuencia regulable
- Puedes escoger entre tres niveles de intensidad (baja, media y alta) que permiten el control de la fragancia emitida
- Es portable y discreto gracias a su funcionamiento con pilas y su pequeño tamaño, permitiéndote así colocarlo donde quieras


Air Wick Diffuseur d'Huiles Essentielles Essential Mist Edition Limitée + 1 Recharge Bois Précieux 20 ml
- Convierte perfumes refinados con aceites esenciales naturales en una niebla ligera y emocionante.
- Ideal para todas tus habitaciones: la posibilidad de ajustar la frecuencia de difusión permite adaptar Air Wick Essential Mist a todas las habitaciones.
- Gracias a su tecnología avanzada, el dispositivo emite agradables olas de niebla perfumada con fragancias agradables.
- Sobre la base del uso del difusor en posición mínima, una recarga ofrece hasta 45 días de fragancia.
- Contiene 1 difusor, 1 recarga y 2 pilas.


Air Wick Essential Mist Recambio Ambientador Nenuco - Paquete de 6 Recambios
- Transforma aceites esenciales naturales en vapor
- Una fragancia fresca y ligera que te transportará al tierno mundo de los bebés
- Disponible en diferentes fragancias: white bouquet; lavanda; flor de vainilla y
- El recambio dura hasta 45 días
- El vapor se libera en intervalos regulados durante 8 horas


Air Wick Varitas Perfumadas - Mikados Ambientador, esencia para casa con aroma a Delicias de Verano - 1 unidad
- Varitas perfumadas
- Fragancia de difusión continuada
- Fragancia que cambia constantemente creando un ambiente más real y acogedor para tu hogar
- Ambientador para el hogar con una fragancia fresca y afrutada
- Hasta 4 semanas de duración


Air Wick Essential Mist Recambio Ambientador Peonia y Jazmín - Paquete de 6 Recambios
- Transforma aceites esenciales naturales en vapor para envolvernos de las fragancias que más nos gustan
- Un aroma delicado basado en flores blancas recién cortadas y jazmín francés con un toque de manzana verde
- Disponible también en las diferentes fragancias: explosión cítrica, lavanda y Flor de vainilla
- El recambio dura hasta 45 días
- El vapor se libera en intervalos regulados durante 8 horas, y se apaga hasta la misma hora del día siguiente


Air Wick Essential Mist Duplo Ambientador Fragancia Explosión Cítrica - 2 Recambios
- Recambio para el ambientador difusor de aceites esenciales naturales Air Wick Essential mist
- Fragancia Energizante Explosión Cítrica, una fusión de frutas cítricas mediterráneas con un sutil toque de exótico ginseng
- El vapor del difusor se libera en intervalos regulados durante 8 horas, y se apaga hasta la misma hora del día siguiente
- Es portable y discreto gracias a su funcionamiento con pilas y su pequeño tamaño, permitiéndote así colocarlo donde quieras
- Descubre el resto de fragancias y ambientadores de Air Wick


Air Wick Essential Mist Recambio de ambientador difusor, esencia para casa con aroma a Lavanda Relajante
- Recambio para ambientador difusor de aceites esenciales Air Wick Essential Mist
- Fragancia Lavanda Relajante, vive una experiencia totalmente sensorial a través de los campos de lavanda con una suave brisa de frutas y maderas
- El vapor se libera en intervalos regulados durante 8 h, y se apaga hasta la misma hora del día siguiente, liberando una sutil fragancia
- Intensidad de fragancia personalizable, cada recambio tiene una duración de hasta 45 días, disfruta de un aroma duradero en tu hogar
- Descubre el resto de fragancias Air Wick Essential Mist


Air Wick Essential Mist - Aparato y recambio de ambientador difusor, esencia para casa con aroma a Explosión Cítrica, pack de 1 aparato y 1 recambio
- Aparato difusor de aceites estenciales Air Wick Essential Mist y recambios
- Fragancia Explosión Cítirca: una fusión de frutas cítricas mediterráneas con un sutil toque exótico ginseng
- El vapor se libera en intervalos regulados durante 8 h, y se apaga hasta la misma hora del día siguiente, liberando una sutil fragancia
- Intensidad de fragancia personalizable, cada recambio tiene una duración de hasta 45 días, disfruta de un aroma duradero en tu hogar
- Descubre el resto de fragancias Air Wick Essential Mist


Air Wick Essential Mist - Aparato y recambios de ambientador difusor, esencia para casa con aroma a Explosión Cítrica - pack de 1 aparato y 4 recambios
- Aparato difusor de aceites estenciales Air Wick Essential Mist y recambios
- Fragancia Explosión Cítirca: una fusión de frutas cítricas mediterráneas con un sutil toque exótico ginseng
- El vapor se libera en intervalos regulados durante 8 h, y se apaga hasta la misma hora del día siguiente, liberando una sutil fragancia
- Intensidad de fragancia personalizable, cada recambio tiene una duración de hasta 45 días, disfruta de un aroma duradero en tu hogar
- Descubre el resto de fragancias Air Wick Essential Mist

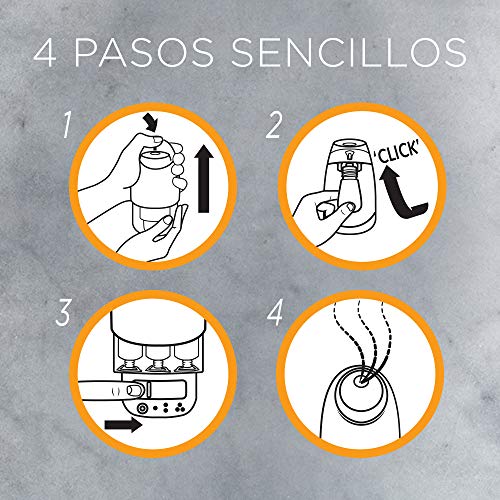
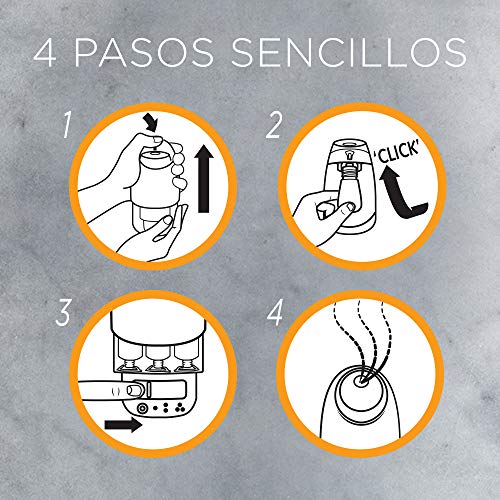
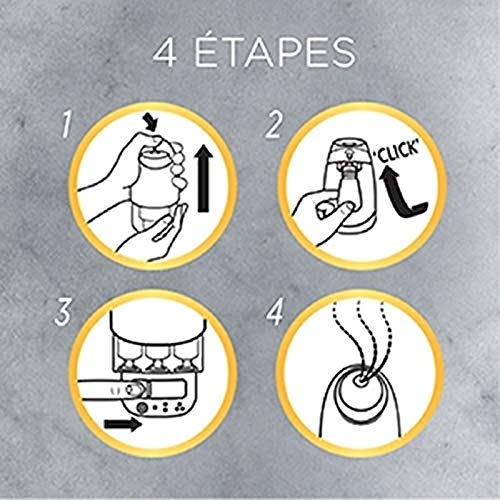
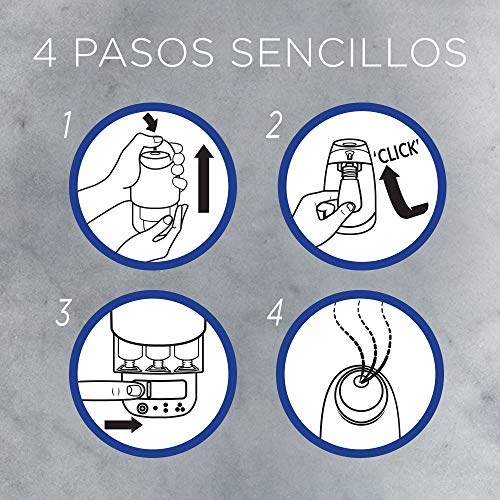
Imágenes de Air wick vapor
Aquí tienes un conjunto de fotografías de air wick vapor para que te hagas una idea y puedas elegir entre todos los modelos de colonia. Pincha en una de las fotografías para ver la ficha completa del producto y su costo.