Planchas pelo iones
Localizar un aroma característico puede llevarnos a experimentar. Deberás averiguar qué género de notas prefieres y cuáles huelen mejor en tu cuerpo. Así sea afrutado, cálido, floral o almizclado, sabrás cuando hayas encontrado ese aroma perfecto que te hable, como podrían ser productos como planchas pelo iones, plancha pelo iones o bien que planchas de pelo. Para cerciorarse de que emite las señales olfativas correctas, aquí hay un resumen de las mejores colonias para hombres y mujeres de todos y cada uno de los tiempos, tanto si precisa una fragancia fresca para el uso diario o algo trágico y audaz para esos instantes especiales. Siempre prueba la fragancia en la piel para ver de qué forma se desarrolla y de qué manera por último se ajusta a tu personalidad. No recomendaría probar más de tres o cuatro aromas diferentes al unísono.
Listado top ventas para Planchas pelo iones
En este listado encontrarás numerosos artículos como planchas pelo iones perfectos para el cuidado de tu salud. Aquí puedes encontrar lo mejor para tu cuerpo, teniendo la oportunidad de comparar entre las mejores marcas y referencias del mercado.

Plancha sin cable BaByliss 9000 con placas de cerámica y batería de iones de litio
- Plancha de pelo inalámbrica de alto rendimiento
- Alisado pulido en una sola pasada con la Tecnología Micro Heating Matrix patentada
- Eficiencia profesional gracias a su exclusiva batería de litio
- Tres ajustes de temperatura: 160°C, 180°C, 200°C
- Carga rápida de 3 horas para 30 minutos de uso a máxima temperatura


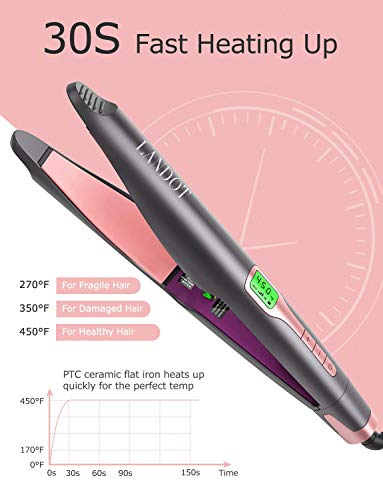
Plancha cabello iones negativos para rizar y alisar 2en1 plancha para alisar el cabello con elemento calefactor de cerámica infrarroja pantalla LCD de temperatura ajustable, calentamiento rápido 45S
- 🎄 【Plancha de pelo de iones negativos 2 en 1 con infrarrojos】 ✔ para un calor rápido y uniforme, sensor de protección térmica para reducir el daño del cabello, revestimiento cerámico de alta calidad. La combinación de alisador de cerámica de versatilidad y tecnología utiliza la tecnología de iones negativos, la tecnología de calentamiento rápido PTC y temperatura constante, la tecnología de infrarrojos y las placas de cerámica de turmalina para lograr un brillo y resultados duraderos.
- 🎅 【Adecuado para todo tipo de cabello】 Las placas 3D flotantes pueden ajustar automáticamente el grosor según el volumen del cabello para reducir la fricción del cabello y deslizarse suavemente. Rizadores y alisadores en uno, adecuados para todo tipo de cabello, cabello liso, cabello rizado.
- ⛄ 【Los iones negativos aumentan la humedad y el brillo】 reducen el cabello y la electricidad estática. La plancha de pelo que libera infrarrojos puede promover el crecimiento de la vida, tener un buen efecto en la activación del tejido celular, fortalecer el metabolismo y promover el crecimiento y la reparación de su cabello.
- 🎁 【Planchas alisadoras iónicas de calentamiento rápido de 45 segundos】 Combinado con otros materiales de peinado como la turmalina o la cerámica puede resultar extremadamente beneficioso para tu cabello y obtener resultados más rápido, la plancha se calienta en un rango de temperatura de 180 ° en 45 segundos C a 450 ° C para que puedas determinar la temperatura óptima para tu tipo de cabello.
- 🎅 【Cable que se puede girar 360 grados】 La plancha de pelo tiene un cable que se puede girar 360 grados, lo que evita eficazmente que los cables se enreden. Un cable de alimentación de PVC resistente de 8 pies le permite usar esta plancha a una gran distancia de la fuente de alimentación. 1 año de garantía!


Actualiza Plancha de Pelo Profesional, Alisador y Rizador 2 en 1 para Curl & Straight en Cerámica Temperatura Ajustable 145°C-230° para Todo Tipo de Cabello Plancha para el Cabello con Iones Negativos
- ღ 2020 Mejora Twisted Curler & Straightener: una combinación perfecta de Curler y Straightener para satisfacer sus necesidades. No solo riza tu cabello como un rizador profesional, también puede ser una plancha de pelo de cerámica retorcida para alisar tu cabello mucho más rápida y fácilmente. Viene con un diseño de tubo circular cercano, el termostato giratorio de cola Curler no puede dañar tu cabello.
- ღ Recubrimiento cerámico y planchas negativas: con el modelo de calentamiento PTC de alta calidad y la placa de titanio, ofrece una distribución de calor constante con un tiempo de calentamiento ultra rápido. Las suficientes planchas de cerámica retorcidas de iones negativos reducen las grietas y los nudos, eliminan el encrespamiento y la estática, crean un peinado más brillante y sedoso en menos tiempo con menos daño en un peinado más rápido durante más tiempo.
- ღ Seguro y ahorro de energía: este alisador rizador utiliza plástico ignífugo de alta calidad con micropeines densos, evita quemaduras en la piel del cuero cabelludo, orejas y dedos. Apagado automático y sistema de control de temperatura física incorporado, este rizador de cabello ondulado se apagará automáticamente si no se usa durante 60 minutos.
- ღ Use Uso fácil y doble voltaje: puede usar este alisador de cabello Irons Twist en casa fácilmente en cualquier ángulo con el cable giratorio de 360 grados. Diseño portátil con el voltaje dual internacional 110-240V que es muy conveniente para viajar. Puede llevarlo a cualquier parte para obtener un peinado sedoso, suave y suavizante en minutos. Es un compañero ideal para que puedas obtener un peinado hermoso en cualquier momento.
- ღ Servicio Life: si tiene algún problema con esta nueva plancha y rizador de actualización de marca nueva, no dude en ponerse en contacto con nosotros, siempre estamos aquí para resolver su problema. Te encantará después de recibir el producto. Es un regalo perfecto para mujeres, madres, amantes, amigos, día de San Valentín, día de la madre, Navidad, etc.


Plancha de Pelo Profesional Ion Alisador y Rizador 2 en 1, Cerámica Planchas Del Pelo, Digital, 11 Ajustes Temperatura Para Todo Tipo de Cabello, Calentamiento Rápido
- 💖【Prevenga el daño del cabello】 Con placas antiestáticas, cerámicas, iónicas de turmalina y con recubrimiento de deslizamiento suave, la plancha de pelo brinda 4 veces más protección, brillo adicional y menos estática (* recubrimiento cerámico estándar VS)
- 💖【Iones para un cabello sedoso y saludable】 Con un generador iónico incorporado, la plancha para el cabello libera ricos iones negativos, lo que le da a tu cabello un aspecto suave, sedoso y brillante natural. Ayuda a reducir el encrespamiento, las puntas abiertas y los nudos, además de aportar brillo y reparar el cabello dañado.
- 💖【Alisador y Rizador 2 en 1】 La placa trenzada única te da la libertad de elegir con el cabello rizado y liso. La plancha de pelo profesional crea resultados dramáticos en incluso el pelo más grueso frizziest; para enderezar, voltear y rizar rápidamente con un mínimo esfuerzo. Sencillo y rápido.
- 💖【Apto para todo tipo de cabello】 La plancha con 11 configuraciones de temperatura variable 130-230 ° C y pantalla digital LCD, que se adapta bien a todo tipo de cabello: cabello largo, corto, grueso, natural y fino
- 💖【Calentamiento instantáneo】 Tiempo de calentamiento rápido de 30 segundos. Cable giratorio 360 ° de 2,0 m de longitud profesional. Apagado automático de seguridad en 60 minutos y con doble voltaje de 110/220 V para que pueda llevarlo en todos sus viajes por todo el mundo.


Plancha de Pelo Profesional, Ceramic Crimper con Revestimiento de Cerámica Alisadora y Rizadora Adecuada, Temperatura Ajustable 120°C-200°C Para Todo Tipo de Cabello
- Rizos y alisadores 2 en 1: esta plancha profesional funciona perfectamente como plancha para el pelo. Al mismo tiempo, esta plancha de pelo también se puede utilizar como rizador. Plancha de pelo 2 en 1 satisface tus diferentes necesidades al alisar o rizar tu cabello
- Materiales de alta calidad: con tecnología cerámica y turmalina, la plancha de pelo emite iones negativos para hacer el cabello más suave. El cabello grueso, el encrespado y las puntas abiertas. La plancha se desliza suavemente a través del cabello sin enredarse. Obtén un aspecto sedoso y encrespado
- 5 ajustes de temperatura 120 – 200 °C para cabello fino a grueso, 180 °C es la mejor temperatura de uso
- Tiempo de calentamiento de 15 segundos, apagado automático de seguridad después de 60 minutos, cable de alimentación giratorio de 360°, cerraduras de seguridad
- Ideal para viajar: el cable giratorio de 100 – 240 V CA y 360 grados evita el enganche. Las cerraduras de seguridad son fáciles de guardar.


Cecotec Plancha de pelo Bamba RitualCare 1100 Titanium Ion Touch. De Titanio, Selector Táctil, Con Ion real, Calentamiento ultrarrápido, Temperatura de 160 y 230 grados, Control y precisión
- Placas con revestimiento de titanio avanzado ultralisas diseñadas para un máximo control y precisión en los peinados. Que permiten obtener un alisado perfecto y unas ondas y rizos flexibles.
- Gracias al selector táctil de temperatura con un rango desde 160º a 230ºC permiten seleccionar la temperatura deseada para cada tipo de cabello de forma rápida y cómoda.
- Gracias al calentamiento ultrarrápido, constante y preciso, alcanzar la temperatura seleccionada es mucho más rápido y de forma controlada.
- Las placas flotantes 3D de nuestra plancha ejercen una presión constante y unificada sobre el cabello para mantener un contacto constante entre placas y mechón.
- El ion real que incorpora genera una carga de iones negativos que produce que se elimine del cabello la electricidad.


Rowenta CF4512 Fashion Stylist 3 en 1 - Planchas de Pelo, Multistyler con 3 Funciones para Alisar, Rizar o Moldear con Recubrimiento Cerámico, Generador de Iones y Dos Temperaturas Ajustables
- Planchas de pelo con 3 funciones de peinado: placas 3D para un moldeado ultramoderno, 2 peines integrados para un alisado eficiente y gran diámetro de 35 mm para unos rizos óptimos
- Generador de Iones : la emisión de iones concentra las moléculas de agua en el cabello, lo que reduce la electricidad estática y el encrespamiento para obtener un cabello suave y manejable
- Recubrimiento cerámico para un deslizamiento sencillo y un acabado sedoso con una mejor distribución de la calor
- 2 ajustes de temperatura que se adaptan a tu tipo de cabello: 170 °C y 200 °C
- Listo para usar en 45 segundos y cable giratorio de 360° para un uso cómodo
- La punta fría garantiza una mayor seguridad al peinarse y una facilidad de manejo


Cecotec Plancha de pelo Bamba Ritual Care 885 Hidraprotect, con revestimiento de Queratina y aceite de Argán, ion real, temperatura ajustable 140-220ºC
- Revestimiento de queratina y aceite de argán, aporta vitamina E; diseño MultiStyle para obtener alisado y ondulaciones flexibles y sin encrespamiento
- El cabello con un acabado ultrabrillante y sin encrespamiento gracias a los iones de carga negativa que genera el ion real
- Placas flotantes 3D para mantener un contacto constante entre placas y mechón, pensadas para reducir tirones y roturas del cabello durante su uso
- Selección de temperatura con botones para un control mucho más sencillo de sus ajustes
- Temperatura ajustable entre 140° C y 220° C; cuenta con temperaturas predefinidas para cabellos finos, normales y cabellos abundantes o muy rizados


Philips Pro HPS930/40 - Plancha de Pelo Profesional, Placas Titanio 110 mm, Ionica, Control Digital Temperatura 140º a 230º, Azul
- Placas recubiertas de titanio para una conducción de calor optima y un 85% mas de durabilidad respecto a la ceramica. Control digital de la temperatura hasta 230º C
- Más cuidado gracias al ionizador y consigue un pelo brillante y sin encrespado
- ThermoGuard evita la exposición al calor no intencionada superior a 200 °C
- Placas largas (110 mm) para un alisado rápido y fácil. Calentamiento en 10 segundos


Rowenta Premium Care Liss & Curl SF7660F0 - Plancha de pelo con función alisadora y rizadora, recubrimiento de cashmere Keratin con aceite de argán, generador de iones, protección cabello
- Recubrimiento exclusivo con cashmere keratin y aceite de argán en combinación con el generador de iones permite obtener un cabello suave y manejable con un brillo radiante
- Plancha con doble función: alisadora y rizadora para alisado adecuado y rizos espectaculares y reduciendo el daño causado por las altas temperaturas a las que se somete al cabello durante el planchado
- Placa inferior flotante que se ajusta en función del grosor del mechón de pelo para mantener una excelente presión sobre el cabello
- Calentamiento rápido en 30 segundos, sistema de bloqueo de las placas para mayor seguridad y cable giratorio de 360° para garantizar comodidad durante el uso
- Apagado automático tras 60 minutos sin usar para mayor seguridad
- Placas de aluminio estrechas, 2,5 cm para un resultado óptimo y display lcd con 5 ajustes de temperatura de precisión (de 130 °c a 200 °c) para un control total


Rowenta Liss & Curl Ultimate Sunshine SF6220E0 - Plancha de pelo con doble salida Iónica, placas aluminio con recubrimiento de nanocerámica ultrashine, función 2 en 1 alisado y rizos Perfectos
- Doble salida iónica que proporciona mayor brillo al reducir el encrespamiento y la electricidad estática; además su recubrimiento nano ceramic consigue un alisado adecuado y cabello más suave
- Plancha con doble función: alisadora y rizadora de pelo alisado adecuado y rizos espectaculares gracias a sus franjas en las placas siendo eficaz con soolo una pasada
- Plancha inferior flotante que se ajusta en función del grosor del mechón de pelo para mantener una excelente presión sobre el cabello
- Placas de aluminio estrechas, 2,5 cm para un resultado óptimo, display led con 5 ajustes de temperatura de 130 °c a 200 °c; incluye un sistema de bloqueo de temperatura
- Calentamiento rápido en 15 segundos, sistema de bloqueo de las placas para mayor seguridad y cable giratorio de 360° para garantizar comodidad durante el uso
- Apagado automático tras 60 minutos sin usar para mayor seguridad


Rowenta CF5820F0 Power Straight Cepillo especial para cabello muy rizado, con generador de iones y temperatura regulable hasta 200
- Cepillo alisador eléctrico especialmente diseñado para cabello encrespado y muy rizado; alisa de manera rápida todo tipo de cabello de manera fácil y ahorrando hasta un 33% del tiempo de planchado y dañandolo menos gracias a su recubrmiento cerámico
- Tecnología en tres pasos: primero sujeta el cabello desde raíz gracias a sus 40 púas, luego estira mediante una malla de 2 tipos de cerdas estira el pelo encrespado; por último alisa desde la raíz a las puntas gracias a sus 100 cerdas calefactadas
- Tecnología termocontrol en las cerdas del cepillo alisador, que difunden un calor constante y homogéneo seguro para el pelo; sus 40 púas de sujeción de raíces atrapan y retienen el pelo desde la raíz
- Con generador de iónes integrados para conseguir resultados brillantes, libres de electricidad estática y con acción anti encrespamiento para resultados más duraderos y rápidos de conseguir
- Temperatura perfecta gracias a su sensor de temperatura integrado que garantiza una temperatura óptima constante: 160°- 180°- 200° para pelo de fino a grueso
- Dos tipos de cerdas para una eficiencia óptima. La malla con 2 tipos de cerdas tensa los encrespamientos y mejora el resultado.


Ga.ma Hair CP1 Plancha alisadora de cerámica con tecnología iónica, color negro
- Anchura de plancha 2,2 cm
- Tiempo de calentamiento de tan solo 10 segundos para 220 °C
- Panchas de protección térmicas adicionales mantienen alejado el calor de las manos


Termix Slim- Plancha de pelo con Nano Titanio, que ayuda a generar iones negativos beneficiosos para el cabello.
- Tecnología iónica: el control de los iones en el cabello lo vuelve más manejable, moldeable y suave, facilitando así que el tiempo de secado sea más rápido de lo habitual
- Nanotecnología: esta plancha de pelo de viaje dispone de nano titanio (nano ti) que ayuda a generar iones negativos beneficiosos para el cabello
- Sistema digital: el control constante de la temperatura ha sido mejorado al implantar un sistema digital. El regulador permite ajustar la temperatura desde los 110º hasta los 230º
- Placas con un ancho de 25mm
- Neceser térmico y protector de dedos incluidos


Remington Pro Ion S7710 - Plancha de Pelo, Cerámica, Digital, Placas Flotantes largas, Tecnología Iónica Triple, Azul y Negro
- Tecnología iónica triple que combate el encrespamiento y la electricidad estática para un cabello suave y brillante, gracias al doble canal de emisión de iones
- Placas flotantes de 110 milímetros con revestimiento de cerámica avanzada ultra con turmalina que elimina el encrespamiento de tu peinado
- Control digital de temperatura con 9 ajustes entre 150 y 230 °C; calentamiento rápido, lista en 15 segundos
- Función de memoria, función turbo y de bloqueo de la temperatura
- Funda resistente al calor, cable giratorio y voltaje universal


Remington S8590 Keratin Therapy Pro - Plancha de Pelo Profesional, Cerámica, Digital, Keratina, Aceite Almendras, Color Bronce
- El sensor de protección contra el calor proporciona hasta 3 veces más protección contra el deterioro, ofreciendo un pelo 5 veces más fuerte frente a una plancha alisadora convencional sin sensor
- Revestimiento de cerámica avanzada con keratina y aceite de almendras
- Placas flotantes de 110 milímetros para una presión uniforme
- Control digital de temperatura con 5 ajustes entre 160 y 230 °C y función turbo. Calentamiento rápido, lista para usar en 15 segundos
- Elegante neceser resistente al calor, cable giratorio y voltaje universal

Imágenes de Planchas pelo iones
Tienes aquí un montón de fotos de planchas pelo iones para que te hagas una idea y puedas seleccionar entre todos los tipos de perfume. Haz click con el ratón en en una de las fotos para ver la ficha íntegra del artículo y su coste.