Sorteos electronica
Un perfume va a ser la primera cosa que procures antes de salir por la puerta, y un aroma que gozarás todo el día. Para asistirte a encontrar una nueva olor para incorporar a tu rutina diaria, hemos encontrado las mejores fragancias, como sorteos electronica, discoteca electronica valencia o bien dr scholl velvet smooth lima electronica, que los críticos adoran por sus aromas universalmente agradables. Afortunadamente, la presión se ha disipado, por el hecho de que tanto si estás buscando un regalo deliciosamente perfumado para un ser querido esta Navidad, tal y como si estás a la caza de tu propia fragancia, estamos aquí para ayudarte con nuestra lista de las mejores olores que este año tiene para ofrecer. Así sea en los días de perro en verano o en una noche de cena en los mejores restaurantes de Michelin, la colonia conveniente puede complementar cualquier ocasión. Si bien muchos expertos pueden eludir aconsejar el empleo de una colonia en una entrevista o bien en la primera cita, en gran medida siempre pasan por alto el mero hecho de que se trata tanto de la aplicación conveniente como del empleo de la mejor colonia para complementar el entorno.
Listado top ventas para Sorteos electronica
Navega por esta relación de distintos productos como sorteos electronica, lo mejor para poder cuidar a tu salud. Encontrarás numerosas referencias de diferentes marcas de calidad excelente y a buen precio para todo lo que necesitas para.

Eléctrico Lotería Máquina Juguete, Eléctrico Lotería Bola Máquina Juguete, Mini Bingo Juego Máquina, Lucky Número Mini Lotería Shake Lucky Bola Picking Máquina - como Se Ve, Tricolour Ball
- Tipo B : Máquina + Lotto (Azul Bola 1-12, Rojo Bola 1-35, 47 Bolas en Total)
- Tipo C: máquina + bola tricolor (no. 1-49, 49 bolas en total, azul / verde / rojo mezclado).
- Juguete eléctrico de la máquina de bolas de lotería Alcance aplicable: promoción comercial, restaurante, cibercafé, restaurante, restaurante de comida rápida, salón de baile, karaoke, etc.
- Tipo A: máquina + la doble cromosfera (bola azul no. 1-16, bola roja no. 1-33, 49 bolas en total).
- Cómo jugar: registre el número que elija, haga clic en el interruptor (el botón amarillo), la pelota saltará al azar, ingresará al túnel y desplegará el número.


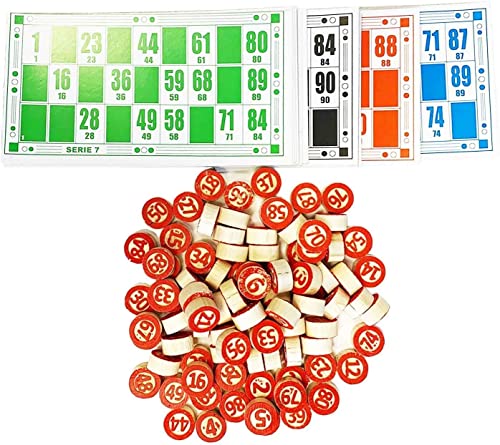
Set Bingo y 48 cartones Bingo de Viaje Juego de Mesa Tradicional Fichas de números 2 Caras Práctica Bolsa de Transporte Números de Madera
- Set de bingo con 90 números en fichas de madera pintadas por las 2 caras y 48 cartones dividido por colores, cada color contiene dos series. Juego de mesa tradicional para jugar con la familia o amigos
- Juego de mesa tradicional para que te diviertas con toda tu familia o amigos. A ver quien canta linea o Bingooooooo! Disfruta de grandes ratos rodeado de tus seres queridos
- Modalidad tradicional con 90 números del 1-90. 48 cartones con 4 colores rojo, verde, azul y negro
- Mantener fuera del alcance de los niños, spuervisar siempre el uso con adultos, riesgo de asfixia por piezas pequeñas. No recomendado para menores de 3 años
- Si buscas garantía en calidad y el mejor servicio, elige EUROXANTY. Si no estás satisfecho con tu compra, devuélvelo y TE REEMBOLSAMOS EL 100% DE TU DINERO


YYYDS Caja Sorpresa Caja de sorteo aleatoria electrónica Llena de Dibujar Sorpresa electrónica
- ❀ Juego: El producto que compra de nosotros es nuevo, no sabe de antemano qué producto obtendrá.Podría ser un drone de alta calidad con una cámara, un proyector 7K, un accesorio para teléfono, un auricular Bluetooth, etc. Es un juego.Ven y adivina lo que obtendrás.
- ❀ No tenga miedo de probar: ¡todas las electrónicas son nuevas!¡Los artículos en su paquete valen tanto o más que el precio que pagó!Su paquete contendrá artículos útiles e interesantes.¡divertirse!
- ❀ Regalos sorpresa: ¡Si está luchando para elegir un regalo para su familia, amigos o usted mismo, entonces nuestra misteriosa caja de regalo electrónico resolverá este problema para usted!Puedes preparar fácilmente los regalos de Navidad para varias personas a la vez.Tenga la seguridad, el producto es nuevo!
- ❀ Aviso a los clientes: Si no le gusta el artículo, no es un problema de calidad y no será devuelto. Es una experiencia en sí misma, un juego emocionante.No tengas miedo de intentarlo.Tenemos sorpresas aún más grandes si compra 2 cajas o más.
- ❀ Posibilidad de obtener: 65% de probabilidad ≥ Valor pagado.25% de probabilidad de obtener más de 2 veces la cantidad pagada.¡8% de probabilidad de ganar dos o más regalos valiosos y un 2% de probabilidad de ganar un premio Misterio!¡Prometemos todos los productos que enviamos son nuevos y que valen la pena!


GIAL Caja Sorpresa Caja de sorteo aleatoria electrónica Llena de Dibujar Sorpresa electrónica
- ❀ Juego: El producto que compra de nosotros es nuevo, no sabe de antemano qué producto obtendrá.Podría ser un drone de alta calidad con una cámara, un proyector 7K, un accesorio para teléfono, un auricular Bluetooth, etc. Es un juego.Ven y adivina lo que obtendrás.
- ❀ No tenga miedo de probar: ¡todas las electrónicas son nuevas!¡Los artículos en su paquete valen tanto o más que el precio que pagó!Su paquete contendrá artículos útiles e interesantes.¡divertirse!
- ❀ Regalos sorpresa: ¡Si está luchando para elegir un regalo para su familia, amigos o usted mismo, entonces nuestra misteriosa caja de regalo electrónico resolverá este problema para usted!Puedes preparar fácilmente los regalos de Navidad para varias personas a la vez.Tenga la seguridad, el producto es nuevo!
- ❀ Aviso a los clientes: Si no le gusta el artículo, no es un problema de calidad y no será devuelto. Es una experiencia en sí misma, un juego emocionante.No tengas miedo de intentarlo.Tenemos sorpresas aún más grandes si compra 2 cajas o más.
- ❀ Posibilidad de obtener: 65% de probabilidad ≥ Valor pagado.25% de probabilidad de obtener más de 2 veces la cantidad pagada.¡8% de probabilidad de ganar dos o más regalos valiosos y un 2% de probabilidad de ganar un premio Misterio!¡Prometemos todos los productos que enviamos son nuevos y que valen la pena!


AKHND Caja de Misterio Caja de sorteos electrónicos Caja aleatoria Caja de ciega aleatoria Regalos de Sorpresa de la Familia inesperada, diversión y Juegos emocionantes, ¡
- La caja de E-Box Lucky significa que los productos en la caja que compró pueden no ser seguros.El objetivo es crear sorpresa y misterio.Tal vez eres suerte!Muchas sorpresas, regalos inesperados para hacer que tu felicidad nunca termine.
- Obtiene: 65% de probabilidad ≥ Cantidad de pago 25% probabilidad = 1.5 veces la cantidad de pago 8% probabilidad = 2 veces la cantidad de pago, 2% probabilidad = ¡Ganar la misteriosa recompensa!
- Los clientes no pueden elegir un color.Este es el paquete preempaquetado proporcionado por el fabricante.Si compra varios conjuntos, puede obtener el mismo color.El paquete puede contener otros productos que no se muestran aquí.
- Si está ofreciendo Navidad y otros regalos de Navidad a sus seres queridos, familiares y amigos, ¡no hay necesidad de perder el tiempo eligiendo regalos!
- Si desea sorpresas, nuestra caja es su mejor apuesta, es posible que tenga la oportunidad de una gran sorpresa, pero si no está dispuesta a arriesgarse a esperar mucho tiempo, este juego podría no ser para usted.


Sorteo


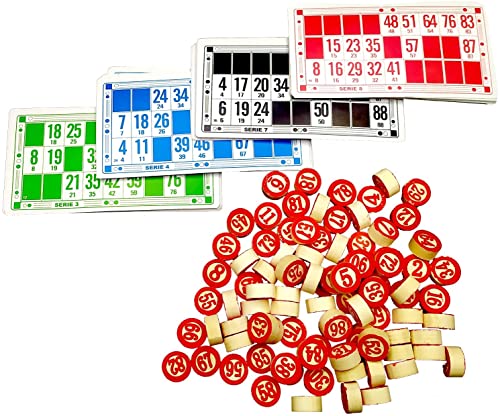
Chicos-Bingo Lotería automática con 48 cartones y 90 bolas imborrables, 23.5 x 31 x 17 cm, incluye fichas de juego, color azul, (Fábrica de Juguetes 20805)
- Contiene 48 cartones de juego
- Bolas con los números gravados, que impiden que se borren con el uso
- Incluye fichas de juego
- No hay nada tan emocionante como que aparezca el número que te falta y poder cantar Bingo a todo pulmón; un juego de siempre para toda la familia


BXU-BG Plataforma Muebles fácil moveing Dolly rectángulo Utilidad Carro con Ruedas en Movimiento Transportador for Sorteos Armario Lavadora Secadora Sofá
- * Material: plástico reforzado PP, todas las rondas son 360 ° rueda giratoria
- * Características: dureza, resistencia al impacto, resistencia a la corrosión, alta y baja resistencia a la temperatura, no es fácil de grieta
- * Fácil de mover muebles u objetos pesados, se puede soportar 150 kg, tamaño: 49.5 * 36.5 * 11cm.
- * Mano-agujero para facilitar su transporte y antideslizante almohadillas de gomaespuma para proteger sus cargas
- Si tienes alguna pregunta, no dude en ponerse en contacto con nosotros y le responderemos en 24 horas!

![Para Bebés – Canciones) 1 – Arreglados para Cancionero – con CD [de la fragancia/Alemán] Compositor: Lutz heyge Lorna De La Serie: Música Jardín Para Bebés – Canciones) 1 – Arreglados para Cancionero – con CD [de la fragancia/Alemán] Compositor: Lutz heyge Lorna De La Serie: Música Jardín](https://www.iesribera.es/pics/2020/10/01/para-bebes-canciones-1-arreglados-para-cancionero-con-cd-de-la-fraganciaaleman-compositor-lutz-heyge-lorna-de-la-serie-musica-jardin-192383.jpg)
Para Bebés – Canciones) 1 – Arreglados para Cancionero – con CD [de la fragancia/Alemán] Compositor: Lutz heyge Lorna De La Serie: Música Jardín
- Salida de la fragancia de música/Score/partituras: para bebés – canciones grapadora 1 – arreglados para luterano – con CD
- Compositor: Lutz heyge Lorna
- Editorial: Mueller S


Herlitz 10733376 - Papeles para rifas numerados del 1 al 500, Multi, Color
- 500 participaciones sin premio.
- Con numeración del 1 al 500.
- Colores surtidos.


Sorteo


Herlitz 1-1000/892703 - Bloque de Papeles Numerados 105x50 mm, 1000 hojas, Colores Aleatorios, Paquete de 10
- Juego de 10 bloques de papel numerados
- La densidad de papel es 60 - 65 g/m2
- Adecuado para el ámbito gastronómico
- Cada bloque dispone de 100 páginas


La Cuponera Online
- Cupones de Descuentos
- Sorteos de todo tipo
- Promociones de los mejores comercios y empresas
- Las mejores Ofertas
- Publicar Cupones de Descuentos
- Servicio totalmente Gratis


ONCE - El Cupón
- Escáner.
- Notificaciones.
- Sintetizador de voz.
- Comprobador de premios.
- Compartir el número premiado.


Casio Reloj de Pulsera R1551100025
- Tiene indicador de fecha y pantalla de neón que brilla en la oscuridad
- Cristal mineral, difícil de rayar, que protege el reloj de daños externos
- Caja de latón y correa de cuero auténtico
- La duración de la batería es de 3 años
- Resistente al agua hasta 5 bar / 50 metros


XLS Medical Forte 5 | Captagrasas | Pierde hasta 5 veces más peso que solo haciendo dieta | Perder Peso | Origen Natural 100% Vegano | 180 Cápsulas, 1 mes
- Consigue tu código de descuento visitando nuestra web xlsmedical.es. El programa personalizado NUDGE gratis 12 semanas te ofrece un plan de dietas, ejercicios y retos para conseguir tu peso objetivo de forma más efectiva - descárgate la app en apple store o google play
- Este captagrasas es un producto sanitario que, junto a una dieta adecuada y ejercicio, ayuda a adelgazar y a quitar los excesos de grasa en el cuerpo - Resultados después del primer mes de tratamiento - ¡Perderás 5 veces más peso que solo haciendo dieta !uye el nivel del índice de masa corporal (imc)
- Formulado con Okranol, un complejo natural patentado a base de fibras vegetales - Clínicamente testado y desarrollado sin colorantes artificiales, conservantes e ingredientes de origen animal
- XL-S Medical Forte actúa reduciendo la grasa existente - Reduce centímetros del contorno de las caderas y la cintura y disminuye el nivel del índice de masa corporal (IMC)
- Los comprimidos ayudan a la pérdida de peso - Cada pack contiene 180 comprimidos equivalentes a 1 mes de tratamiento
- 97% de los consumidores satisfechos con resultados de perdida de peso*
- Producto sanitario; cumple con la normativa de productos sanitarios; debe utilizarse con una dieta hipocalórica adecuada, actividad física y estilo de vida saludable; CPSP19162CAT


Kindle, ahora con luz frontal integrada, negro
- La luz integrada regulable te permite leer durante horas dentro y fuera de casa, tanto de día como de noche.
- Diseñado para la lectura: dispone de una pantalla de 167 ppp y alto contraste en la que se lee como en papel impreso, sin ningún reflejo, incluso bajo la luz del sol.
- Lee sin distracciones. Subraya pasajes, busca definiciones, traduce palabras o ajusta el tamaño del texto: todo ello sin abandonar la página que estás leyendo.
- Elige entre millones de libros. Tiene capacidad para miles de títulos, así que siempre podrás llevar tu biblioteca contigo.
- Los miembros Prime tienen acceso a cientos de libros.
- Una sola carga y la batería dura semanas, no horas.

Imágenes de Sorteos electronica
Tienes aquí un conjunto de fotografías de sorteos electronica para que te formes una idea y puedas seleccionar entre todos los modelos de colonia. Pincha en en una de las fotografías para ver la ficha íntegra del producto y su coste.