Cremas con calcio
Obtener una fragancia durable es casi tan difícil como ganar la lotería. Si estás a la caza de una nueva fragancia que se adapte a tu estilo y que dure bastante tiempo, descubre opciones como cremas con calcio, nivea vital calcio o bien loreal activos antiedad calcio. Por fortuna, la presión se ha disipado, porque tanto si buscas un regalo exquisitamente perfumado para un ser querido esta Navidad, como si estás a la caza de tu propia fragancia, estamos acá para asistirte con nuestra lista de las mejores olores que este año tiene para ofrecer. No hay nada de malo en olisquear como un trabajador, pero cuando llega la hora de refrescarse, ayuda a tener una ventaja. Bastantes personas ni siquiera se dan cuenta de lo esencial que es localizar y emplear una olor sensual.
Listado top ventas para Cremas con calcio
Esperamos que con este inventario de productos encuentres cremas con calcio al mejor precio y mejor calidad para el cuidado y bienestar de tu salud. En este momento puedes encontrar lo mejor para tu cuerpo, comparando entre las mejores marcas y modelos del mercado.

Crema hidratante L'Oréal Paris antiarrugas de noche con calcio, 3 unidades (50 ml).
- Suaviza las arrugas más profundas.
- Piel nutrida y resistente.
- Regenera la piel durante la noche.


L'Oréal Paris Crema facial antiarrugas, Experte 55+ crema de noche para mujer a partir de 55 años con calcio, 3 unidades (50 ml).


L 'Oreal Paris Age Perfect Golden Age Cuidado de día, con Neo de calcio y Posies Extracto de, Proporciona un rosig de teint fresco, 50 ml
- Crema de día revitalizante e hidratante antienvejecimiento para fortalecer y prevenir la flacidez de la piel, adecuada para todos los tipos de piel
- Resultado: piel inmediatamente hidratada y alisada sin sensación de tensión, reafirmante la piel día tras día sin encorvar la piel, contornos faciales más precisos
- Aplicación diaria sobre el rostro limpio, movimientos circulares para una mejor absorción de la crema hidratante, corte de la zona de los ojos
- Extracto de peonía para estimular la piel y conseguir un brillo rosa fresco, enriquecido con calcio B5 para reafirmar los contornos faciales y mejorar la tensión
- Contenido del envío: 1 crema de día L'Oréal Paris Age Perfect Golden Age de color rosa, 50 ml


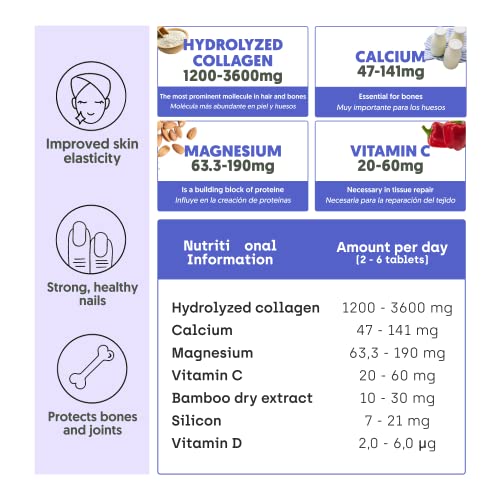
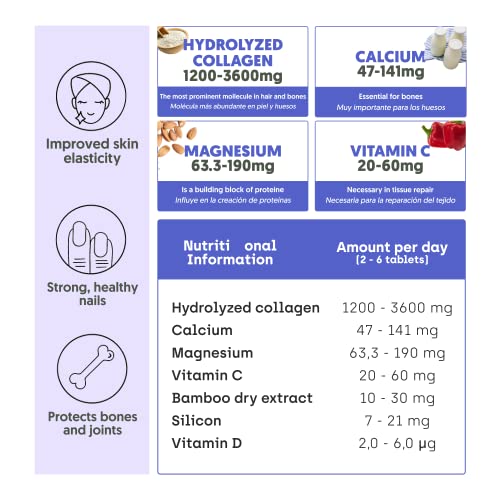
Colágeno Hidrolizado con Magnesio | Bote XXL, 450 Cápsulas (6 meses) | Potenciado con Calcio y Vitamina C para Piel, Articulaciones, Pelo, Músculos, Sistema Inmunológico y más Energía
- 🌿 PROTEGE DE FORMA NATURAL: este suplemento protege y refuerza la piel, el pelo, las uñas, los huesos, los músculos y las articulaciones con este colágeno hidrolizado de NutriBrain de alta calidad elaborado a partir de la mejor combinación de vitaminas minerales
- 🦴 COLÁGENO CON FUNCIÓN ESENCIAL: El colágeno es la proteína más abundante y su función es esencial para el correcto funcionamiento del cuerpo humano. La mayor parte del tejido conectivo y de la piel, cabello y uñas, están formadas por colágeno. En torno a los 25 años baja la producción de colágeno, causando envejecimiento y otros problemas de salud que pueden ser prevenidos con una adecuada suplementación de colágeno
- 👄 PIEL JOVEN, SANA Y FIRME: una mayor densidad de colágeno en la piel es perfecta para las líneas de expresión, para la elasticidad de la piel y para el envejecimiento
- 🤚 CONOCE TODOS LOS BENEFICIOS: complemento contra el dolor articular, para el estado de la masa muscular, la pérdida ósea, el crecimiento de un pelo sano y fuerte, la elasticidad y la hidratación de la piel, el cansancio, fatiga y el sistema inmunológico
- 🤸♀️ CALIDAD CON GARANTÍA: tableta de 450 cápsulas de colágeno hidrolizado con magnesio de NutriBrain para un cuerpo, cara, piel y ojos fuerte, en caso de no estar plenamente satisfecho se ofrece una garantía de devolución sin compromiso


NIVEA MEN Hyaluron Pack Cuidado Facial Antiedad Hombre, pack de hombre con crema antiedad (1 x 50 ml) y contorno de ojos (1 x 15 ml)
- Kit de regalo – Este set de baño para hombre incluye una crema hidratante antiedad y una crema para ojos. Es una opción ideal como caja de regalo.
- Cuidado antiedad – La crema antiarrugas de este set reafirma la piel para un aspecto más joven, hidrata 24 horas y reduce las arrugas visiblemente.
- Contorno de ojos – Esta crema antiojeras con ácido hialurónico reduce las ojeras y combate las arrugas alrededor de los ojos para un aspecto sano y más joven.
- Protección solar – La crema facial hidratante incluye factor de protección solar 15 que ayuda a prevenir el envejecimiento inducido por el sol.
- Contenido del envío – NIVEA MEN Hyaluron Pack Cuidado Facial Antiedad Hombre, Crema Hidratante FP15 (50 ml) y Contorno de Ojos Antiedad (15 ml), neceser.


Crema de día Nivea antiarrugas + vitalidad, 55 + 50 ml, 50 ml
- Mitiga las líneas y las arrugas visibles.
- Previene el envejecimiento prematuro de la piel debido a la luz FPS 15.
- Refuerza la piel seca y madura.
- Previene la aparición de nuevas arrugas gracias al SPF 15.
- Porque su piel vive


Cien VITAL Crema de noche regenerativa
- Cien VITAL Crema de Noche Regenerativa 50 ml


Venpharma, Crema corporal - 200 ml.
- Producto de alta calidad
- Productos para tu cuidado personal
- Leche corporal 200 ml venpharma de 200


Gc Tooth Mousse Protección Diente Crema Fresa, 1-Pack (1 X 40 G)
- Crema a base de agua y sin azúcar diseñada para restaurar el equilibrio mineral en la cavidad oral
- Mejora la profilaxis cuando puede ocurrir la desmineralización de los dientes
- Puede reducir la hipersensibilidad bloqueando los túbulos dentinarios
- Tiene una cantidad de 40 g


L'Oréal Paris Perfect Golden Age Rosé - Cuidado ocular con calcio B5 y extracto de peonía, contra ojeras oscuras, 15 ml
- El extracto de peonía estimula el color natural de la piel en la profundidad y devuelve poco a poco la luz rosada fresca.
- El calcio B5 ayuda a la piel a construir su densidad y, por lo tanto, contrarrestar la pérdida de la piel.
- La zona de los ojos es intensamente hidratada, tiene un efecto más fresco y oscuro, las ojeras profundas son menos visibles.
- Día a día, el contorno de los ojos se siente más firme y firme.
- Para piel muy madura y grisácea – adecuado a partir de 60 años.


L'Oreal Paris Skin Expert - Crema de Día Nutritiva Anti-Arrugas, Tratamiento con Calcio para Pieles de +55 - 50 ml
- Crema nutritiva anti-arrugas de día a base de calcio, para pieles a partir de los 55 años
- Formulada con calcio, está diseñada para combatir la falta de nutrición y de colágeno más visible de la edad
- Reduce las arrugas y la sequedad, mejorando y restaurando la elasticidad y firmeza de la piel
- Consigue una hidratación óptima y una adecuada jugosidad en el rostro y cuello durante 24 horas
- La piel se vuelve más lisa, flexible y luminosa, la elasticidad aumenta y su apariencia mejora visiblemente día tras día


L'Oréal - Age Perfect Nutrition Supreme - Crema nutritiva de noche para piel madura - 50 ml
- Fortalece la barrera de la piel gracias a su fórmula enriquecida con Pro-Calcio y jalea real
- Enriquecida con Pro-El calcio ayuda a fortalecer la barrera de la piel y la piel recupera su consistencia
- Gracias a la fórmula jalea real penetra en la epidermis para nutrir la piel intensamente
- Noche tras noche la piel se nutre intensamente y relajarse, encontrar su consistencia


L'Oreal Paris Dermo Expertise Tratamiento Anti- Arrugas Expert, Crema De Día, Retino Péptidos +45 - 50 ml
- Para pieles +45
- Crema de día
- Combate las arrugas


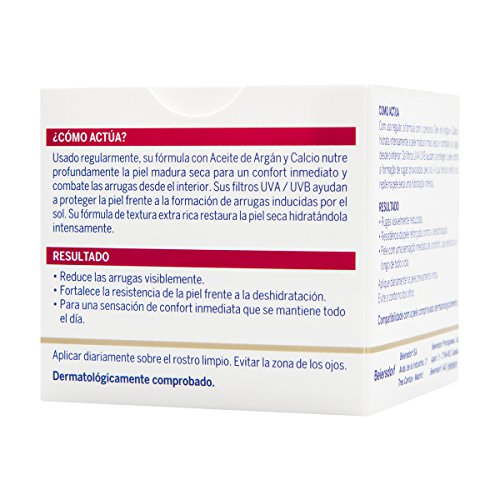
NIVEA VITAL Calcio Cuidado de Día Extra Nutritivo, crema antiedad de cuidado facial, antiarrugas para dar vitalidad y luminosidad a la piel madura - 1 x 50 ml, Estándar (4005900092465)
- Crema nutritiva: Esta crema antienvejecimiento aporta hidratación y nutrición flash durante 24 horas, cubriendo las necesidades de la piel madura muy seca
- Cuidado antiarrugas: Además de aportar luminosidad y vitalidad a la piel madura, esta crema facial reduce las arrugas y protege de agresiones medioambientales
- Aceite de argán: Enriquecida con aceite de argán y calcio, la fórmula de esta crema de día fortalece la resistencia de la piel frente a la deshidratación
- Rápida absorción: con su textura suave de rápida absorción, esta crema hidratante antiarrugas penetra rápidamente y deja la piel con un acabado jugoso
- Contenido del envío: NIVEA VITAL Calcio Cuidado de Día Extra Nutritivo, crema facial antiarrugas con filtros UVA/UVB, 1 x 50 ml, bote


Ana Maria Lajusticia - Colágeno con magnesio – 450 comprimidos articulaciones fuertes y piel tersa. Regenerador de tejidos con colágeno hidrolizado tipos 1 y 2. Envase para 75 días de tratamiento.
- El colágeno con magnesio interviene en la regeneración del tejido osteomuscular
- El colágeno con magnesio contribuye a la salud del tejido conectivo como la piel, cabello y uñas.
- El colágeno es la proteína más abundante en el cuerpo humano
- El magnesio contribuye a disminuir el cansancio y la fatiga
- Contribuye a mantener y aumentar la masa muscular


Chicco - Pasta de dientes 12 m+ con flúor y cálcio biológico, sabor fresa (BIO)
- Contiene fluoruro sódico (1000 ppm F-)
- No daña los dientes de leche
- Con calcio biológico
- Sabor fresa
- Fórmula sin conservantes


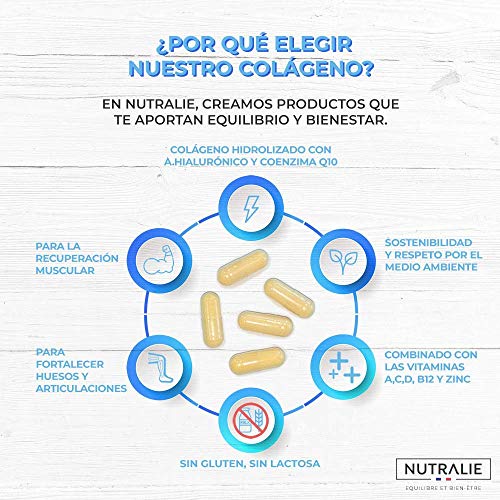
Colágeno + Ácido Hialurónico + Coenzima Q10 + Vitaminas A, C, D y B12 + Zinc | Energía y Articulaciones Fuertes | Colágeno Hidrolizado en 60 cápsulas | Nutralie
- COLÁGENO HIDROLIZADO: Combinado con ácido hialurónico, vitaminas A, C, D y B12, zinc y coenzima Q10, nuestro Colágeno Complex es un producto muy completo que ha sido producido bajo los más estrictos protocolos de calidad para disfrutar al máximo de sus beneficios.
- MÁXIMA ABSORCIÓN: Creado para que nuestro cuerpo pueda aprovechar al máximo este componente. El colágeno hidrolizado garantiza la máxima absorción en el organismo, y al combinarse con la vitamina C, contribuye a la formación normal de colágeno en nuestro cuerpo.
- PARA ARTICULACIONES, PIEL Y HUESOS: El colágeno contribuye al mantenimiento de la piel en condiciones normales, al funcionamiento normal del sistema inmunitario y al mantenimiento de los músculos y huesos en condiciones normales, así como a disminuir el cansancio y la fatiga.
- CALIDAD NUTRALIE: Presentado en 60 cápsulas, nuestro Colágeno ha sido elaborado bajo un proceso controlado y certificado bajo los más estrictos protocolos de calidad, desde el origen hasta el producto final.


L'Óreal Paris Dermo Expertise - Age Perfect Golden Age, crema iluminadora de día con protección solar SPF 20, para pieles maduras y apagadas - 50 ml
- Crema de día con protección solar para pieles maduras y apagadas
- Reaviva el tono rosado natural de tu piel y devuelve la consistencia y densidad para una mayor firmeza
- Su fórmula incluye extracto de peonía imperial y de íris
- Protege la piel de los efectos dañinos de los rayos UV gracias a la protección solar SPF20
- Aplicar la crema todos los días con movimientos ascendentes sobre la piel del rostro y cuello previamente limpia

Imágenes de Cremas con calcio
Aquí puedes ver una agrupación de imágenes de cremas con calcio para que te hagas una idea y puedas escoger entre todos los tipos de perfume. Pincha en en una de las fotos para ver la ficha íntegra del artículo y su coste.