Botella helio
¿Puedes decir la diferencia entre los perfumes económicos y los caros? Referencias como botella helio, helio puro o bien botella miu, escogidos por especialistas, pueden olfatear tal y como si costasen un buen dinero, mas todos son sorprendentemente accesibles. ¿No está seguro de lo que le gusta, o bien no está seguro de de qué manera poner sus preferencias en palabras? Las familias de fragancias pueden ser un buen punto de partida: las fragancias van a caer en una categoría floral, fresca, afrutada, cítrica, oriental, amaderada o picante - todo bastante fácil y revelador. El toque final de cualquier buena apariencia es la confianza para llevarla a cabo, y la forma más rápida de animar esa autoconvicción es buen rocío de tu aroma favorito. Puesto que el olfato es una de las conexiones más poderosas con los centros de placer y los recuerdos de nuestro cerebro, el perfume que elija no solo puede evocar ciertas emociones en los que le rodean, sino que puede definir temporadas enteras de su vida.
Listado top ventas para Botella helio
Te mostramos nuestro listado de artículos gracias al cuál podrás encontrar botella helio que cumplan las necesidades de tu salud. Aquí puedes encontrar lo mejor para tu salud, comparando entre las mejores marcas y referencias del mercado.

Party Fiesta Botella de Helio Mediana de 20-30 Globos de 22 cm
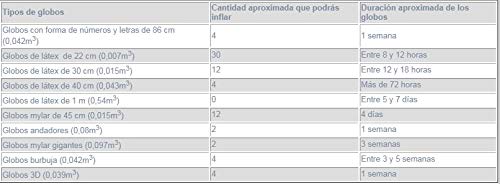
- Si quieres rellenar los globos de helio tu mismo, aprovecha y compra ésta botella de helio desechable. Botella de helio desechable de tamaño grande, con capacidad de 0,25 metros cúbicos. Con ella podrás inflar aproximadamente 20-30 globos de 22cm, o bien 12 globos de 28cm, o bien 12 globos mylar de 45cm.
- Para los globos de látex la duración es aproximadamente entre 4 a 7 horas y para los de foil más de 24 horas. Con esta bombona grande podrás inflar globos tanto de látex como de foil de una manera rápida, sencilla y segura.
- No se incluyen los globos ni la cinta.
- Los globos inflados con helio flotarán aproximadamente el tiempo indicado en la tabla siguiente, pero la duración de los globos en buen estado puede variar en función de la humedad, calor, focos de luz....
- Te aconsejamos que, si vas a inflar globos de látex, lo hagas como máximo 3 horas antes del evento.
- La bombona es de acero y es desechable. Para reciclarla, puedes llevarla a tu punto de reciclaje más próximo. Antes, comprueba que no quede gas en su interior flexionando la boquilla.
- Instrucciones de uso:
- - Gira la manija verde hacia la izquierda para abrir la válvula. - Desliza el cuello del globo en la boquilla negra. – Mantén el cuello del balón firmemente entre el pulgar y el dedo índice en la parte más ancha de la boquilla. - Presiona la boquilla hacia abajo suavemente para inflar. La bombona dispone de una boquilla de goma flexible que libera el gas al flexionar, cortando el suministro al soltar.
- - Rellena globo al tamaño deseado. - Libera la presión del pulgar sobre la boquilla para detener el inflado. - Después de inflar globos de látex, retíralos de la boquilla y anúdalos si se trata de globos de látex. - Coloca la cinta de la longitud deseada por debajo del nudo de los globos de látex o de la zona inferior en los globos mylar. Una vez hayamos terminado de inflar los globos, si aún queda gas, cerraremos la llave para asegurarnos de que éste no se escape.


Bombona de Helio para Globos (hasta 50 globos de látex incluidos)
- -GLOBOS DE LÁTEX: hasta 50 globos a 20 cm de diámetro o hasta 42 globos a 23cm de diámetro o 35 globos 25 cm
- -GLOBOS DE LÁTEX : duración de los globos de látex de 4 a 12 horas según tamaño de hinchado
- -GLOBOS DE FOIL O METÁLICOS: consultar al fabricante del globo el helio que necesita el globo
- -DURACIÓN DE LOS GLOBOS DE FOIL O METÁLICOS: depende de la calidad del globo, algunos duran semanas


Bombona de Helio para Globos 0,25M3
- Para 25 globos de látex hinchados a 23cm de diámetro
- Duración globos látex de 6 a 8 horas.


Bombona de Helio Mister Helio (0,42m3) hasta 50 globos (globos no incluidos)
- -GLOBOS DE LÁTEX: con esta bombona puedes hinchar hasta unos 50 globos de látex a 23 cm
- -DURACIÓN: los globos de látex pueden durar de 4 a 12 horas según el tamaño de hinchado
- -GLOBOS FOIL O METÁLICOS: sólo pueden volar si miden más de 45 cm, de lo contrario no vuelan con helio
- - Los globos metálicos o foil pueden durar días incluso semanas volando con helio
- - Si vas a usar globos de látex lo mejor es que los hinches justo antes del evento


Bombona de Helio Desechable 0.13m3 para inflar 15 Globos de Latex de 25cm (Globos No Incluidos)
- Bombona de Helio para Globos 0.13m3 sin Globos. Comprar Bombona Helio para Globos con la Máxima Calidad y al Mejor precio en DonGlobo. Distribuidor y Venta de Helio CAPACIDAD DE INFLADO Y TIEMPOS DE FLOTACION: * Globos de Látex Redondos y Corazones 25cm: 15 Globos --> Estos globos tendrán un Tiempo de Flotación de 8 Horas
- * Globos de Látex Redondos y Corazones 30cm: 10 Globos --> Estos globos tendrán un Tiempo de Flotación de 15 Horas
- * Globos de Foil Redondos, Corazones y Estrellas 45cm: 10 Globos --> Estos globos tendrán un Tiempo de Flotación de 4 Días
- * Globos de Foil Super Formas entre 60-90cm: 2-3 Globos --> Estos globos tendrán un Tiempo de Flotación de 4 Días
- * Globos de Foil Letras y Números entre 86-100cm: 2-3 Globos --> Estos globos tendrán un Tiempo de Flotación de 4 Días


Comius Globos de Helio, 5 Pcs Globos de Papel de Aluminio, Inflado Gigante Globo de la Hoja para Decoración de la Fiesta de Bodas de Cumpleaños Vacaciones (Botella de Vino)
- 。◕‿◕。 Fabricado en papel de aluminio de alta calidad, con válvula autosellante y reutilizable
- 。◕‿◕。 Diseño de doble cara, más atractivo, puede llenarse con aire o helio
- 。◕‿◕。 El color brillante y el diseño dulce pueden alegrar el ambiente alegre
- 。◕‿◕。 Incluyendo piña, rosquillas, flamenco, sol, champán, globo rosado de la botella, globo verde de la botella, globo de la botella de whisky, globo dorado de la copa de vino, globo de la taza de cerveza de Cheers
- 。◕‿◕。 Acompañamiento perfecto para cualquier tipo de fiesta, cumpleaños, eventos de baile


Pack 2 Bombonas de Helio para Globos (para 100 globos de latex no incluidos)
- -GLOBOS DE LÁTEX: para 100 globos a 20 cm de diámetro
- -GLOBOS DE LÁTEX : duración de los globos de látex de 4 a 12 horas según tamaño de hinchado
- -GLOBOS DE FOIL O METÁLICOS: consultar al fabricante del globo el helio que necesita el globo
- -DURACIÓN DE LOS GLOBOS DE FOIL O METÁLICOS: depende de la calidad del globo, algunos duran semanas


We Are Party Bombona de Helio Maxi 0,42m3 para 50 Globos.
- Capacidad: 0,42m3. Consulta debajo en detalles del producto cuántos globos puedes inflar, cuanto duran flotando e información importante.
- Incluye 50m de cinta ribbon blanca para atar los globos.
- Incluye boquilla flexible para fácil inflado y válvula de seguridad. Debidamente precintada como garantía de calidad.
- No incluye los globos ¡Mira nuestros packs con globos!
- Apto para inflar los llamados “airswimmers”, "airwalkers" y otros artículos. Envasado y comercializado en la UE.


Bombona de Helio para Globos (para 10-15 globos de látex no incluidos)
- -GLOBOS DE LÁTEX: para 15 globos a 20 cm de diámetro o para 10 globos a 23cm de diámetro
- -GLOBOS DE LÁTEX : duración de los globos de látex de 4 a 12 horas según tamaño de hinchado
- -GLOBOS DE FOIL O METÁLICOS: consultar al fabricante del globo el helio que necesita el globo
- -DURACIÓN DE LOS GLOBOS DE FOIL O METÁLICOS: depende de la calidad del globo, algunos duran semanas.


Bombona de Helio para Globos 0,42lt (50 globos de latex 23 cm no incluidos)
- -GLOBOS DE LÁTEX: para 50 globos a 23 cm de diámetro
- -GLOBOS DE LÁTEX : duración de los globos de látex de 4 a 12 horas según tamaño de hinchado
- -GLOBOS DE FOIL O METÁLICOS: consultar al fabricante del globo el helio que necesita el globo
- -DURACIÓN DE LOS GLOBOS DE FOIL O METÁLICOS: depende de la calidad del globo, algunos duran semanas


THE HELIUM COMPANY Bombona de Helio para Globos (para 20-30 Globos de Latex no incluidos)
- -GLOBOS DE LÁTEX: para 30 globos a 20 cm de diámetro o para 25 globos a 23cm de diámetro o 20 globos a 25 cm
- -GLOBOS DE LÁTEX : duración de los globos de látex de 4 a 12 horas según tamaño de hinchado
- -GLOBOS DE FOIL O METÁLICOS: consultar al fabricante del globo el helio que necesita el globo
- -DURACIÓN DE LOS GLOBOS DE FOIL O METÁLICOS: depende de la calidad del globo, algunos duran semanas.


Bombona de Helio Desechable Mister Helio, para hinchar 50 Globos de Latex incluidos
- 100% helio
- la botella de Helio más molona


Bombona de Helio Mr. Helio+ Globos látex Azul y Perla
- Bombona de helio Mr.helio
- 30 globos látex azul y perla (duración globo con helio 6 horas)
- Cinta azul


Bombona de Helio Desechable Mister Helio + 30 Globos de Latex. La Botella de Helio más molona
- -GLOBOS DE FOIL O METALICOS: consultar al fabricante del globo si este vuela con helio, y la cantidad de este que necesita el globo

Imágenes de Botella helio
Si prefieres elegir de forma visual los productos, puedes observar aquí una agrupación de imágenes de botella helio. Pincha una de las imágenes y pasarás a la compra online de colonia en concreto viendo sus funcionalidades y valor.