Perfumes que se parecen entre si
No es preciso tener los detectores olfativos de un perro rastreador para saber qué olores no te gustan, mas es difícil determinar la olor que quieres derrochar cuando tienes tantas opciones. Con cada marca de alto perfil y cada celebridad produciendo una nueva olor cada un par de meses, nos resulta bastante difícil determinar cuáles son las que verdaderamente resaltan y cuáles solo causan mal olor. Aguardamos que productos como perfumes que se parecen entre si, entre perfumes o bien entre naranjos cumplan tus espectativas. Por suerte, la presión se ha disipado, por el hecho de que tanto si buscas un regalo exquisitamente perfumado para un ser querido esta Navidad, tal y como si estás a la caza de tu propia fragancia, estamos aquí para asistirte con nuestra lista de las mejores olores que este año tiene para ofrecer. En el momento en que un olor pasa por la parte superior de la nariz y entra en el bulbo olfativo del cerebro, el cerebro interpreta el olor, prácticamente como piezas de un rompecabezas, dice el famoso perfumista explicando por qué razón el perfume puede tener un efecto tan intenso en nuestros estados de ánimo y recuerdos. Esa información es llevada a la amígdala, donde se procesan las emociones, luego va a la una parte del cerebro donde se forma la memoria.
Listado top ventas para Perfumes que se parecen entre si
Echa un vistazo por esta enumeración de distintos productos como perfumes que se parecen entre si, lo mejor para cuidar a tu salud. Encontrarás varias referencias de distintos modelos con buena calidad y con predio competitivo para todo lo que necesites para tu bienestar.

HOMCOM Vitrina de Pared Vitrina de Madera con Estantes Ajustables y 2 Puertas Correderas de Vidrio para Colecciones Perfumes Figuras de Decoración 80x9,5x60 cm Blanco
- VITRINA DE EXPOSICIÓN: Esta vitrina de pared es muy adecuada para colocar varios objetos pequeños de colección, como medallas conmemorativas, figuras, perfumes, etc. Deja que tus objetos más preciados destaquen entre los muebles de tu hogar
- ESTANTES AJUSTABLES: Esta estantería expositora cuenta con 4 estantes ajustables en altura que te permiten configurar el espacio de almacenaje de forma flexible para artículos de tamaños diferentes
- PUERTAS DE CRISTAL: Esta vitrina cuenta con 2 grandes puertas de cristal correderas. Para que tus invitados, visitantes o tú mismo puedas disfrutar de tus colecciones desde todos los ángulos, a la vez que están protegidas
- MONTADA EN LA PARED: Esta vitrina viene con todos los accesorios incluidos para su montaje en la pared. Presta atención en mantenerla en posición horizontal durante el montaje
- MEDIDAS TOTALES: 80x9,5x60 cm (LxANxAL); Medidas de cada puerta: 39x57,5 cm (LxAL); Medidas de cada estante: 77x7,5 cm (LxAN); Se requiere montaje


TENN Limpiador Brillante Espuma - 500 ml
- Tenn brillante espuma, la limpieza perfecta que se ve y se huele
- Con tenn brillante espuma conseguirás un increíble brillo para cristales y superficies verticales gracias a su formato en espuma
- Con fórmula efecto reparación para las superficies de tu hogar
- Ofrece un secado rápido y baja espuma que no deja rastros
- Instrucciones para su uso adecuado: Agítese antes de usar; pulverizar sobre la superficie a limpiar; dejar actuar (si se desea) pasar un paño y listo
- Ingredientes: Contiene, entre otros ingredientes: Menos del 5% de tensioactivos aniónicos; también contiene perfume (Benzyl alcohol, Benzyl salicylate, Butylphenyl mathypropional, Citronellol, Hexyl cinnamal, Linalool) y conservantes (Benzisothiazolinone, Methylisothiazolinone); contiene Polieterpolifosfato
- Advertencia de seguridad: Provoca irritación ocular grave; puede ser corrosivo para los metales


Humidificador Ultrasònico Difusor 450ML Ambientador Aromaterapia Silencioso Apagado Automtico Luces LED 7 Colores Aceites Esenciales Dormitorio Bebe Yoga Oficina Spa Libre de BPA
- 🎉【Frasco de aceite esencial natural puro】:Nuestro Humidificador contiene 6 * 10 ml de aceite esencial, aceite esencial de aromaterapia hecho de extractos vegetales naturales, seguro y eficaz para el cabello y la piel;Contiene: mar, Cerezo, rosa, Campanilla, lavanda y Gardenia, es un regalo perfecto para cualquier Festival.Como Navidad, cumpleaños, San Valentín, etc.(Attention:Essential oils are placed in the diffuser)
- 🌿【Capacidad de 450 ML y interruptor de apagado automático】:La capacidad de 450 ml de agua puede proporcionar hasta 12 horas de funcionamiento continuo sin recarga.Una vez que se agote el agua, el difusor se cerrará automáticamente, muy seguro;Sólo necesita añadir 2 - 3 gotas de aceite esencial en el agua todos los días para lograr el efecto de aromaterapia, relajarse.
- 💐【Lámpara LED de 7 colores】: El LED se puede configurar en 7 Colores suaves y suaves diferentes y se puede utilizar como lámpara nocturna.Pulse el botón "luz" para ajustar el color de su luz favorita.Si apagas las luces, dormirás mejor.Además, se puede utilizar como decoración para crear un ambiente muy romántico.Una buena elección para el día de San Valentín o cumpleaños.
- 💕【Un Estado de ánimo tranquilo y relajado】: Sueño profundo, funcionamiento suave, sin ruido≤20db), le proporciona un ambiente tranquilo y cómodo.Usted sólo necesita aliviar el estrés y disfrutar de una relajación profunda. El Humidificador puede ayudar a eliminar la fatiga, hidratar y nutrir las células, dejando la piel húmeda, limpia, blanca y natural.
- 🎁【Configuración del temporizador y control remoto】Difusor de aroma con temporizador (60 Min / 120 Min / 180 Min / estable), 2 salidas de vapor ajustables: débil / fuerte;Usted puede abrir / cerrar fácilmente sin dejar la cama y el sofá, cambiando el patrón de niebla de bajo a alto, el difusor de aroma en sí, especialmente para los niños.Adecuado para dormitorio, Sala de estar, oficina, yoga, Spa, etc.


Difusor de Aceites Esenciales,SALKING 100ml Difusor de Aromaterapia,Humidificador Aceites Esenciales Ultrasónico con LED de 7 Colores y 4 Temporizadores, para el Hogar,Regalos Originales para Mujer
- ✅ Diseño Único- SALKING humidificador ultrasónico es el único con diseño de materiales metálicos tallados antiguos en el mercado, siempre es de moda y único. Humidificador aceites esenciales está 100% hecho a mano. El acabado de patrón combina la elegancia clásica y la modernidad. Este difusor coincide perfectamente con una variedad de estilos de decoración interior.El difusor aceites esenciales de SALKING también son regalos considerado y convenientes para mujeres.
- ✅ 4 Temporizadores y 7 Luces Coloridas - El difusor aromaterapia tiene 4 modos de configuración de tiempo: 0.5 hora / 1 hora / 2 horas / 3 horas. Hay 7 colores ajustables de la luz, puede cambiar entre el modo de ciclo gradual y el modo fijo de un color para elegir sus favoritos. El humificadores aromaterapia también puede utilizarse como una lámpara de noche, ayudándole a dormirse mejor.
- ✅ Operación Ultrasónica - La pulverización es más delicada y suave, mejorando la seguridad mientras mejora el esencias para humidificador en sí mismo, y se pulveriza uniformemente. Los vaporizador aceites esenciales son beneficiosos para la absorción y la relajación. Proporciona humedad para la Tos Seca, Irritación Sinusal, también es perfecto para enmascarar los olores de fuma y mascotas. Difusor sea casi sin ruido (inferior a 15 dB) cuando funciona y refresca en habitaciones de 20 a 25 m².
- ✅ Sin BPA y Sin Agua Auto-Apaga - El humificadores aromaterapia SALKING está hecho de material PP ecológico y libre de BPA. El humidificador SALKING difusor se apagará automáticamente cuando se agote el agua, agregando la seguridad y la eficiencia de energía. Es un aceites esenciales aromaterapia seguro suficientemente, no se necesita preocupar de que se olviden de apagarlo incluso se lo da a personas mayores.
- ✅ Servicia - El difusor de aceite SALKING proporciona un reembolso de 30 días + garantía de 1 año + servicio al cliente amigable de 24 horas. El purificador de aire para hogar lo ayuda a mejorar la calidad del aire, aliviar la ansiedad y la depresión. Ya sea que quiera Relajarse, Concentrarse, Purificarse, Energizarse o Dormirse, tenemos perfecta solución para usted. Cómprelo sin preocupación.


Aceite Barba Orgánico Hombre 50ml Sapiens Barber Shop - Certificado ECOCERT 100% Natural - Enriquecido con Aceite de Ricino y Vitamina E - Hidrata y Favorece el Crecimiento - Fabricado en Francia
- 🍃 Un aceite para barba orgánico Certificado Cosmos Organic/ ECOCERT hecho en Francia con ingredientes naturales: El aceite barba Sapiens está elaborado con aceites vegetales naturales y orgánicos (aceite de ricino, aceite de argán, almendra dulce, aceite de jojoba, vitamina E). No contiene conservantes, ni aromas artificiales, ni materias primas controvertidas. Probado por nuestro equipo de barbudos, no en animales. Fragancia natural amaderada.
- 💈 Hidrata, suaviza y favorece el crecimiento de tu barba: El aceite para barba Sapiens ayuda a hidratar la barba y la piel de debajo para reducir el picor. Este cuidado barba suaviza y nutre el pelo en profundidad para que la barba quede suave y sedosa sin dejar una película grasa. La fórmula está enriquecida con aceite de ricino y vitamina E para estimular el bulbo piloso y favorecer el crecimiento de la barba.
- ✅ Frasco de vidrio de 50 ml con boquilla a presión: El frasco de vidrio y su boquilla de empuje permiten dosificar el aceite para barba Sapiens con precisión y facilidad. Poner dos chorros de aceite para barba Sapiens en la palma de la mano. Calienta el aceite entre las manos y aplícalo en la barba, masajeando bien para que los aceites penetren en profundidad. A continuación, cepille su barba con un cepillo de cerdas de jabalí para masajear y disciplinar a fondo su barba.
- 🇪🇸 Servicio posventa muy reactivo en español : Estamos muy atentos a la calidad de nuestros productos, por lo que todos nuestros productos para el cuidado de la barba y nuestros cosméticos se fabrican en nuestro laboratorio situado en Francia. Si tiene algún problema o pregunta, hacemos todo lo posible para responderle lo antes posible (en un plazo de 24 horas) y ofrecerle un servicio posventa reactivo y atento.
- ☀️ Garantía de satisfacción : Es difícil describir la textura del aceite o la sensación en la barba, nada sustituye la experiencia que se tiene. Por eso le ofrecemos un reembolso sin preguntas si no está satisfecho, así que no dude en ponerse en contacto con nosotros.


SALKING Difusor Aceites Esenciales,260ml Humidificador Ultrasónico,Metal Difusor de Aromaterapia con 7 Colores,4 Configuraciones de Temporizador y Sin Agua Auto-Apaga, Regalo para Mujer
- Silencioso y Neblina Refrescante - Atomice el agua pura del aceite esencial en niebla ultrafina a través de la tecnología de atomización ultrasónica. El aroma del aceite esencial flota en el aire, la salida de la niebla dura 15 horas, el humidificador aceites esenciales silencioso de 35dB aliviará la ansiedad de por el insomnio, y acompañará perfectamente su noche dulce.El difusor aromaterapia mejorará en gran medida la eficiencia de su trabajo y aprendizaje.
- 4 Temporizadores y 7 Luces Coloridas - El purificador de aire para hogar tiene 4 modos de configuración de tiempo: estable / 1 hora / 3 horas / 5 horas. Hay 7 colores ajustables de la luz, puede cambiar entre el modo de ciclo gradual y el modo fijo de un color para elegir sus favoritos. El humidificador ultrasónico también puede utilizarse como una lámpara de noche, ayudándole a dormirse mejor.
- Decoración del Hogar y Regalo Ideal - Diseño Único Retro de Metal. El aspecto elegante se integra con su mueble, también puede usarlo como una hermosa decoración y ambientador casa de mesa para su acompañante. El difusor aceites esenciales de SALKING también son regalos considerado y convenientes para mujeres. El aceites esenciales aromaterapia es la tendencia popular.
- Sin BPA y Sin Agua Auto-Apaga - El humificadores aromaterapia SALKING está hecho de material PP ecológico y libre de BPA. El humidificador SALKING difusor se apagará automáticamente cuando se agote el agua, agregando la seguridad y la eficiencia de energía. Es un aceites esenciales aromaterapia seguro suficientemente, no se necesita preocupar de que se olviden de apagarlo incluso se lo da a personas mayores.
- Servicia - El humidificadores bebes SALKING proporciona un reembolso de 30 días + servicio de 1 año + servicio al cliente amigable de 24 horas. El ambientador humidificador contiene 260 ml de agua y se difunde en habitaciones de 30-45 m². Sumérjase en la vida de aromaterapia.


THECOSMETICREPUBLIC - Cubre Raíces Negro - 75ml
- El Cubre Raíces Dark (Negro) es un espray para retocar raíces de manera temporal y cubrir canas instantáneamente.
- Está hecho con pigmentos minerales y no contiene ni amoniaco ni peróxidos, lo que lo hace más natural y respetuoso para el cabello.
- No mancha la ropa, las sábanas, ni se cae por el sudor o la lluvia. No gotea, ni mancha la cara, ni arruina el maquillaje.
- Gracias a su difusor ergonómico de 180° es muy fácil de aplicar, gastando menos y cubriendo más. ¡La mejor solución para cubrir las raíces entre tinte y tinte!
- El Cubre Raíces viene en 4 tonos ( Rubio/ Castaño / Negro / Caoba )


WANDA PLATA, Gargantilla chapitas para Mujer, Plata de Ley 925 bañado en Oro, Colgantes Redondos, Círculos Gargantilla Monedas Chapas, Multichapas, Collar Mujer Joven en Caja de Regalo
- Collar Chapitas plata de ley 925 con baño de oro
- El largo del collar es de 38 cm mas una cadena extensora de 5 cm. El diámetro de las chapitas es de 3 mm
- Cuidados de la Joya: Si quiere que su joya se mantenga bien durante mucho tiempo, es muy importante que no entre en contacto con el perfume, pues se comerá el baño de oro, por otro lado no debe dormir con la joya, y guardarla, cuando no la use, en la bolsita que recibe dentro de la caja. El contacto con la piel hará que la joya se vaya ensunciando y es conveniente limpiarla con regularidad .
- Wanda plata es una marca española, todas nuestras joyas están hechas en España o Italia.
- Todas nuestras joyas están hechas con plata de ley 925 primera con garantía verificada de autenticidad y calidad. Recibirás la joya en una caja de regalo.

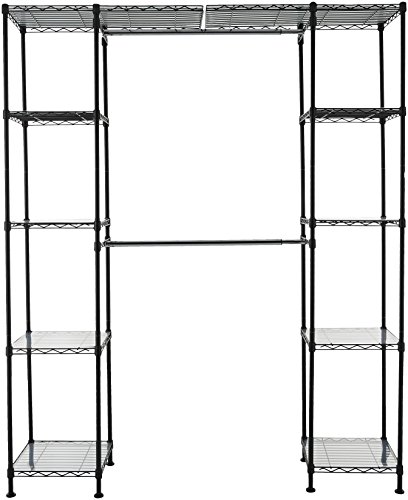
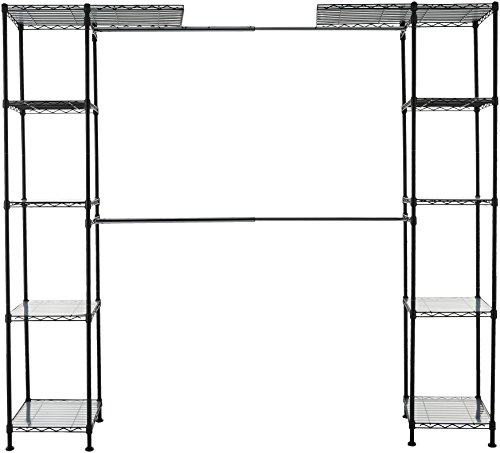
AmazonBasics - Sistema organizador de armario extensible, Negro
- Organizador de armario extensible con 2 barras de colgar de anchura ajustable que se pueden subir o bajar en intervalos de 2,54 cm
- 10 estantes de altura ajustable, 5 en cada lado; cada estante sostiene 45,3 kg y pueden subirse o bajarse en intervalos de 2,54 cm
- Hecho de alambre de acero duradero y fundas de plástico; acabado en Negro elegante; 4 patas niveladoras extranchas para mayor estabilidad
- Montaje sencillo que se atornilla entre sí; incluye forros de estantes de plástico y accesorios de montaje a pared para mayor seguridad
- Mide 35,5 x 147 cm hasta 160 x 183 cm (largo x ancho x alto)


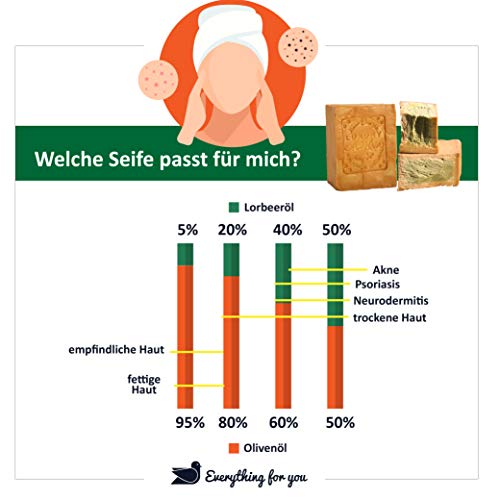
Jabón E4U original Aleppo, clásico 60% aceite de oliva, 40% aceite de laurel, aprox. 200 g vegano, jabón natural, jabón de ducha, jabón de afeitar, receta tradicional de Orient.
- ✔ ALEPPO SEIILISEIFI, Eï al 100% natural producto que imita el sur de Turquía a través de un procedimiento convencional. La composición se compone solo de aceite de oliva puro, aceite de laurel de laurel, sova y agua pura. El valor de pH está entre 8 – 9, por lo que es muy adecuado para el cuidado general del cuerpo. Adecuado para bebés y niños.
- ✔ Arrisia se fabrica al 100% con aceites naturales de interés natural. El jabón con 40% de aceite de laurel y 60% de aceite de oliva es rico en vitamina A y E. Tiene una propiedad antioxidante. Nunca se ha utilizado para experimentos con animales. Mientras que el jabón limpia la piel, absorbe su humedad intensa, hace que la piel se refuerza y la regenera. Se utiliza para el cuidado diario de la piel y el cabello, así como para máscaras faciales. Se puede utilizar como exfoliante.
- ✔ El jabón de Alepo actúa contra la caída del cabello. Dado que contiene un alto porcentaje de aceite de laurel, evita la formación de caspa. Eficaz contra el envejecimiento de la piel. Relájate varices. Adecuado para bebés y niños.
- ✔ Mientras que el jabón de Alepo limpia la piel, aporta mucha humedad, la hace elástica, refuerza la piel y la regenera. Se utiliza para el cuidado diario de la piel y del cabello, así como para mascarillas faciales, exfoliantes o incluso como jabón de afeitar.
- ✔ 100% de interés religioso al cliente. Si el jabón de Aleppo 100% natural no encaja con tu piel, póngase en contacto con nosotros, para que podamos organizar la devolución y reembolsar el precio de compra completo. Ningún riesgo.


Lenor Unstoppables Spring Perlas Impulsoras De Fragancia - 210 g
- Un impulso de frescura en cada lavado
- Impulsor de fragancia con una combinación de frescas notas florales realzadas con lirio, azahar y rosa
- Personaliza la intensidad de la fragancia según la cantidad de perlas que desees utilizar
- Verter las perlas directamente en el tambor vacío antes de la colada
- Los impulsores de fragancia Lenor Unstoppables están disponibles en diferentes aromas


NEWTECK Secadora de Ropa Eléctrica Portátil Secadry XXL, Secadora por Ventilación, 1200W, Gran Capacidad 15 Kg, Temporizador 180 min, 3 Niveles, Silencioso, Multifunción: Secadora, Armario, Tendedero
- SECADORA ROPA CON PTC CERÁMICO POR VENTILACIÓN: fabricado con material cerámico de PTC para un calentamiento rápido, eficiente y ahorro de energía. Material ignífugo ABS. Temporizador ajustable de 30 a 180 minutos. Estructura de acero inoxidable, muy ligero y fácil de mover. Tamaño: 715x450x1650 mm., Potencia: 1200W.
- GRAN CAPACIDAD: 15 Kg. de capacidad de almacenaje y 10 Kg. de capacidad de secado. Incorpora 3 niveles de secado. Nivel central muy fácil de desmontar para dejar que cuelguen las prendas más largas sin arrugarse. Mantiene la ropa más esterilizada, gracias a la alta temperatura, ayuda a eliminar malos olores, las bacterias y los ácaros, la contaminación del aire.
- POTENTE VENTILADOR SILENCIOSO: Ventilador ultra silencioso de alta velocidad, bajo nivel de ruido, con temporizador hasta 180 minutos. Auto-apagado al terminar el tiempo programado. Calienta rápidamente 360º, velocidad de secado más rápida, economiza el uso de energía. Control de temperatura inteligente: se apagará automáticamente cuando detecte sobrecalentamiento.
- MULTIFUNCIÓN: Secadry XXL ofrece diferentes usos en un solo dispositivo, es útil como secadora portátil, armario o tendedero. Incluye 4 ruedas flexibles, para facilitar el movimiento o traslado a la posición deseada. Apto todo tipo de prendas de ropa, toallas, juguetes de peluche, sábanas, zapatos, almohadas… entre otros.
- PROTEGE LA ROPA Y FACILITA EL PLANCHADO: Gracias a su sistema de secado, evita que la ropa se frote entre sí cuando está seca, como en las secadoras habituales. Por lo que protege la ropa y sus fibras, durará más tiempo. Facilita el planchado minimizando la aparición de arrugas en la ropa, gracias al su diseño que permite colgar la ropa en perchas para el secado. Además, previene de la contaminación secundaria, protege la ropa durante el secado bajo la funda, evitando la invasión de polvo.


Collar Mujer, Árbol de la Vida Plata de Ley 925 Colgante con Cristales Swarovski,Ideal Regalo para Madre/Esposa/Navidad/Cumpleaños
- 【El diseño más innovador y elegante.】 - Este collar colgante de chakra hecho a mano de árbol de la vida es único. La diseño nuevo elegante se destaca entre los muchos collares del árbol de la vida. No solo hay cinco coloridos cristales de Swarovski en el árbol de la vida, sino que un pequeño círculo de cristales de Swarovski rodea el árbol de la vida.Contemporáneo y elegante, es el toque chispeante perfecto para cada ocasión.
- 【Cristal de Swarovski】- Swarovski es el fabricante líder mundial de cristales cortados con precisión. Por eso todos nuestros cristales están hechos con cristal Swarovski auténtico de la mejor calidad. Para obtener los mejores resultados del producto, compramos cristales de la fábrica de cristal más grande del mundo para garantizar la máxima calidad y centrarnos en nuestro propio diseño.
- 【S925 MATERIALES DE PLATA DE LEY】 - Collar hecho de plata de ley 925, no causará ningún daño o malestar a su piel. Sin níquel, sin plomo, sin cadmio, Mano de obra exquisita. La cadena es delicada pero fuerte. No se te romperá. El collar es ajustable con un extensor de cadena, Longitud de la cadena: 40 5 cm. No te preocupe el collar colgante no encajaría.esterlina S925. Gran calidad para durar toda la vida. Collar cadena ajustable nunca te fallará. árbol de la vida para siempre es uno de los col
- 【REGALOS OFICIALES PARA MUJER】 - El collar para mujer viene en una elegante caja de regalo de joyería, ideal para cualquier ocasión de regalo. Grandes regalos para la mujer, regalos para la novia, regalos para la mamá, regalos para la suegra, regalos para la esposa, etc. Regalos de cumpleaños ideales, regalos de aniversario, regalos de Navidad, regalos de graduación, regalos del día de la madre, regalos del día de San Valentín, etc. Un toque moderno y sofisticado para cualquier atuendo.
- Maravilloso regalo y garantía de calidad? - Si quieres enviar regalos para cumpleaños o fiestas, nuestro collar colgante de cristal azul Swarovski es la mejor opción para llevar el AMOR a tu madre o a tus hermosas chicas. Nuestro collar de joyas es 100% nuevo. Si tiene alguna insatisfecha o problema para nuestro producto. Reemplazaremos uno nuevo o le daremos un reembolso completo.


Lenor Unstoppables Dreams Perlas Impulsoras De Fragancia , 210 g
- Un impulso de frescura en cada lavado
- Impulsor de fragancia con una explosión de jazmín y sofisticado aroma de vainilla
- Personaliza la intensidad de la fragancia según la cantidad de perlas que desees utilizar
- Verter las perlas directamente en el tambor vacío antes de la colada
- Los impulsores de fragancia Lenor Unstoppables están disponibles en diferentes aromas

Imágenes de Perfumes que se parecen entre si
Aquí tienes un montón de fotografías de perfumes que se parecen entre si para que te hagas una idea y puedas elegir entre todos los tipos de perfume. Pincha en en una de las fotos para ver la ficha completa del producto y su costo.