Phyto 5 elementos
Para asistir a guiar tu búsqueda, es una gran idea pensar en las fragancias conforme a las distintas categorías: florales, frutales, madereras o limpias, ya que la mayoría de la gente se inclina innatamente hacia una de ellas. Eso te va a ayudar a reducir las opciones, cuando menos un tanto y vas a poder enfocarte en productos más atractivos para ti como phyto 5 elementos, la phyto o bien sisley phyto. Ya sea que se trate de fragancias florales, perfumes picantes, acordes de oud, o aromas dulces que le gusten, o que le guste la última y más grande fragancia en marcha o que sea un fanático de los viejos tradicionales, hemos reunido los mejores perfumes de todos los tiempos para inspirar su busca. No hay de qué. Vayamos al grano. Existen muchas colonias diferentes en el mercado, y es prácticamente imposible ver (u oler) si funcionan de forma eficaz con tu piel. Ciertas mayores casas de tendencia del mundo están generando en masa, y no siempre con los estándares que cumplimos acá en mrperfume.es.
Listado top ventas para Phyto 5 elementos
Queremos que con este inventario de productos encuentres phyto 5 elementos al mejor precio y con la calidad óptima para el bienestar y cuidado de tu salud. Si quieres encontrar sinfín de opciones para poder comprar lo mejor para tu cuerpo, te encuentras en uno de los mejores sitios web del mercado.

Omega 3 Aceite de Pescado - 400 Cápsulas de Omega 3 en forma de triglicéridos (Suministro para 14 meses) - 1000mg por Cápsula - Con ácidos grasos Omega 3 EPA y DHA
- ✅ CÁPSULAS DE ACEITE DE PESCADO EN FORMA DE TRIGLICÉRIDOS: Cada cápsula de gelatina blanda de Omega 3 Premium de alta dosificación contiene 1.000 mg de aceite de pescado por dosis diaria (1 cápsula). Los valiosos ácidos grasos omega 3 incluyen 180 mg (EPA) y 120 mg (DHA) por dosis diaria.
- ✅ 400 CÁPSULAS PARA MÁS DE 13 MESES DE OMEGA 3 - Cada bote contiene 400 cápsulas de gelatina blanda. ¡35 cápsulas de gelatina blanda y un mes completo más que otras marcas!
- ✅ SIN SABOR A PESCADO - Nuestras cápsulas te permiten obtener los ácidos grasos de Omega 3 sin sabor a pescado. Las cápsulas softgel son altamente absorbentes para el máximo beneficio y utilidad.
- ✅ ACEITE DE PESCADO OMEGA 3 EN FORMA DE TRIGLICÉRIDOS REESTERIFICADOS - La forma de triglicéridos es la que se encuentra de forma natural en el pescado y en los lípidos en general, por lo que es fácilmente reconocida como natural por el organismo, lo que la hace más biodisponible y por eso el cuerpo lo absorbe mejor y más fácil. Utilizamos únicamente aceite de pescado puro procedente de anchoas de la costa de Chile encapsulado en Alemania.
- ✅ CALIDAD PREMIUM - FABRICADOS EN ALEMANIA - Producidos bajo los más altos estándares de calidad y los más estrictos controles en Alemania, cada producto GloryFeel está sujeto a pruebas de laboratorios.


Plusvive - 365 cápsulas de omega 3 con recubrimiento de gelatina de pescado (1000 mg)
- 365 cápsulas de omega 3
- Altamente dosificado: cada cápsula contiene 1000 mg de aceite de pescado puro
- Respetuoso con el medio ambiente: nuestro aceite de pescado se extrae de anchoas recolectadas de forma sostenible
- Con cápsulas de gelatina de pescado: a diferencia de la mayoría de los productos de la competencia, que utilizan gelatina de cerdo o de vaca, nuestras cápsulas están hechas exclusivamente de gelatina de pescado
- Máxima calidad: este producto es sometido a frecuentes pruebas y cumple con los más altos estándares internacionales, incluidos los de HACCP y GMP
- Fabricado en Alemania en una fábrica acreditada


Colágeno + Ácido hialurónico + Vitamina C natural + Biotina + Zinc + Selenio + Extracto de bambú - Para la piel, articulaciones, los huesos y el cabello -180 cápsulas (Suministro para 3 meses)
- ✅ EXCELENTE RELACIÓN PRECIO-CALIDAD Y ALTA BIO DISPONIBILIDAD - SUMINISTRO COMPLETO PARA 3 MESES - 180 cápsulas de Ácido hialurónico + Colágeno hidrolizado - Suplemento completo para la piel y el cabello con ácido hialurónico (500-700kDa), colageno hidrolizado, biotina, selenio, zinc, extracto de bambú y vitamina C natural de la acerola con la mejor relación precio-rendimiento.
- 🌞 COMPLEJO PREMIUM PARA LA PIEL-CABELLO-UÑAS * - La biotina, el zinc y el selenio contribuyen al mantenimiento del cabello, piel y uñas normales 💅 La vitamina C, el zinc y el selenio contribuyen cada uno a una función normal del sistema inmunológico 🛡️ Además, la vitamina C contribuye a una formación normal de colageno para una función normal de la piel* - Por lo tanto, nuestro Complejo de Acido hialuronico + Colágeno es la combinación ideal de sustancias vitales.
- 🌿 100% PURO, VEGANO Y SIN ADITIVOS - Nuestro Complejo de Ácido hialurónico + Colágeno de alta calidad se produce sin aditivos artificiales como los estearatos de magnesio, agentes separadores, saborizantes, colorantes, estabilizadores, rellenos, gelatina u otros ingredientes animales y, por supuesto, SIN INGENIERÍA GENÉTICA. Sin lactosa, sin gluten y sin conservantes.
- ✅ CALIDAD DE MARCA FABRICADA EN ALEMANIA – Todos nuestros productos se producen bajo los más altos estándares de calidad en instalaciones estrictamente probadas y certificadas, premiadas con ISO y, como es requerido por la ley de alimentos, con certificado HACCP en Alemania!
- 🔬 PROBADO POR LABORATORIO INDEPENDIENTE - Cada producto GloryFeel está sujeto a pruebas continuas por laboratorios alemanes acreditados, certificados de acuerdo con la norma DIN EN ISO/IEC 17025.


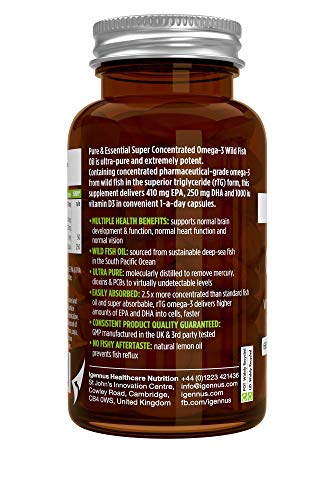
Pure & Essential Aceite de Pescado Salvaje Omega-3 410 mg EPA y 250 mg DHA por cápsula y Vitamina D3, sabor a limón, 60 cápsulas
- CONCENTRACIÓN 2.5x MÁS ALTA: una única cápsula libera una alta dosis de ácidos grasos omega-3 EPA y DHA (660 mg) – dos veces más que grandes cápsulas de aceite de pescado estándar (300 mg) y cuatro veces más que aceite de hígado de bacalao (160 mg).
- OMEGA-3 DE ACCIÓN RÁPIDA: Los triglicéridos reesterificados (rTG) son extremamente biodisponibles, ofrecen una absorción más rápida y eficiente y aumentan los niveles de omega-3 en nuestras células 3.5x más que el aceite de pescado en forma de triglicérido estándar y 5x más que el aceite de krill.
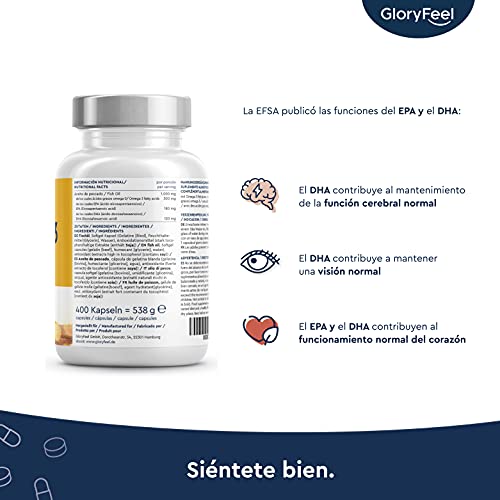
- MÚLTIPLES BENEFICIOS PARA LA SALUD: omega-3 EPA y DHA apoya la función cerebral, la salud cardiovascular y de la visión, tanto como la respuesta inflamatoria y la función del sistema inmunológico. La vitamina D3 apoya la división celular, los huesos, los dientes y la función muscular.
- ACEITE DE PESCADO SALVAJE ULTRA PURO: destilado molecularmente y certificado libre de metales pesados, dioxinas y PCBs. El aceite de limón natural evita cualquier reflujo de pescado.
- PRODUCTO DE CALIDAD FARMACÉUTICA: fabricado en el Reino Unido, conforme las buenas prácticas de fabricación (BPF). Probado por terceros para garantizar pureza, ingredientes activos, valor nutritivo y seguridad.


Omega 3 Aceite de Pescado Puro 3000 mg - 990 mg de EPA + 660 mg DHA - Efecto Antiinflamatorio y Antioxidante, Suplemento para la Salud de Cerebro, Hígado y Corazón, Controla Colesterol, 60 Cápsulas
- ✔ CONCENTRACIÓN MÁS ALTA DEL MERCADO 3000 MG POR DOSIS: tome 3 de nuestras cápsulas de aceite de pescado salvaje obtendrá una dosis 3000 mg al día de ácidos grasos Omega 3, que es la más alta del mercado. Además, nuestra fórmula supera a otros suplementos de omega 3 al proporcionar 990 mg de EPA y 660 mg de DHA en cada porción.
- ✔ FÓRMULA ENRIQUECIDA CON DHA: nuestras cápsulas de aceite de pescado Omega 3 de máxima potencia están diseñadas para proporcionar un cuidado total de su cuerpo, pero también para su cerebro, ya que contienen una porción abundante y saludable de DHA por lo que mejorará su concentración. Además con el obtendrá todos los aceites esenciales naturales. Además estos aceites esenciales son muy beneficiosos para mejorar la memoria.
- ✔ MÚLTIPLES BENEFICIOS PARA LA SALUD: el aceite de pescado Omega 3 es uno de los mejores ingredientes naturales para cuidar Del corazón, el colesterol y el hígado, además de proporcionar un soporte esencial de ácidos grasos para el cabello y la piel. Este complemento alimenticio es excelente para apoyar la salud cardiovascular, la visión, la respuesta inflamatoria y el sistema inmunológico.
- ✔ SUPLEMENTO OMEGA 3 NATURAL SIN QUÍMICOS AÑADIDOS: nos hemos asegurado de que este suplemento no contenga más que el ácido graso de aceite de pescado omega 3 más puro con DHA y EPA, y nada más. También proviene de aceite de hígado de bacalao premium que está completamente libre de productos químicos o conservantes añadidos. Además nuestras cápsulas no tienen ni olor ni sabor.
- ✔ GARANTÍA DE DEVOLUCIÓN DEL DINERO DE 90 DÍAS: WeightWorld ofrece una variedad de suplementos naturales provenientes de proveedores de gran calidad y utilizando los mejores procesos de fabricación. Sabemos que los suplementos no funcionan de un día para otro, pero si no se encuentra satisfecho con el resultado estamos dispuestos a reembolsar el dinero ¡Si tiene alguna pregunta acerca del producto no dude en preguntarnos!


Omega 3 (2000 mg) - 660 mg de EPA y 440 mg de DHA - 240 Capsulas de Gel Suave de Aceite de Pescado Puro (Suministro para 4 meses) - Hecho en el Reino Unido por Nutravita
- ✔¿POR QUE NUTRAVITA OMEGA 3 CAPSULAS? - Una alta fuente de DHA (440mg por dosis) y EPA (660mg por dosis), que contribuyen a la función normal del corazón, para proporcionar cantidades adecuadas de ácidos grasos esenciales para ayudar a mantener el colesterol sanguíneo normal y la función cardíaca saludable respaldada por la EFSA (Autoridad Europea de Seguridad Alimentaria).
- ✔ SUMINISTRO DE 4 MESES: El Omega 3 suplemento de Nutravita ofrece una increíble relación calidad-precio que le brinda el suministro de 120 días de la nutrición esencial que su cuerpo necesita para trabajar de manera óptima. Nuestras cápsulas de gel suave están diseñadas para ser fáciles de tragar.
- ✔ ALTA PUREZA Y ALTA POTENCIA - El aceite de pescado Omega 3 Optimum de Nutravita contiene aceite de pescado puro, libre de contaminantes, libre de gluten, libre de lactosa, libre de rastros de nuez y libre de OGM.
- ✔ COMPRAR CON CONFIANZA - Nutravita es una marca bien establecida en el Reino Unido, en la que confían clientes de todo el mundo. Todo lo que fabricamos se fabrica aquí mismo en el Reino Unido utilizando los ingredientes de mayor pureza y protegidos por los estándares de fabricación más altos del mundo (GMP, BRC).
- ✔ ¿CUÁL ES LA HISTORIA DETRÁS DE NUTRAVITA? - Nutravita es una empresa familiar establecida en el Reino Unido en 2014; desde entonces, nos hemos convertido en una marca de Vitaminas y Suplementos reconocida y de confianza por parte de nuestros clientes en todo el mundo.


Phyto Duophanere Suplemento alimentar para cabello y uñas, 2 x 120 capsulas
- Tipo de piel: Normal
- Para el cabello: Normal
- Marca: Phyto

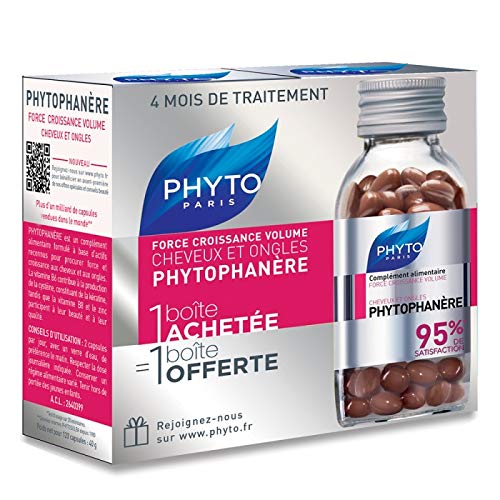
Phyto Phytophanere - Suplemento alimenticio para el cabello y las uñas - 4 meses de tratamiento - En cápsulas de 120 + 120
- Suplemento alimenticio Phyto Phytophanere, aporta fuerza y vitalidad al cabello y uñas frágiles.
- Favorece el brillo y la vitalidad de la piel y a través de la biotina ayudando a mantener saludable el cabello.
- 4 meses de tratamiento, en cápsulas de 120 + 120.
- Suplemento alimenticio que aporta fuerza y vitalidad al cabello y uñas frágiles.
- 2 cápsulas al día con un vaso de agua, preferiblemente por la mañana.

Imágenes de Phyto 5 elementos
Tienes aquí una serie de fotografías de phyto 5 elementos para que te hagas una idea y puedas escoger entre todos los modelos de perfume. Pincha con el ratón en una de las fotos para ver la ficha completa del producto y su precio.